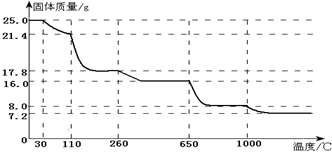
题目内容
13.关于下列实验操作的说明不正确的是( )| A. | 向某溶液中滴入石蕊呈红色,滴入甲基橙则呈黄色,则该溶液的pH值可能为4.4~5.0 | |
| B. | 电解水时加入H2SO4、NaOH、CuCl2等电解质均可增加导电性,而会使电解水的速率增大 | |
| C. | 配制标准NaOH溶液的NaOH固体含有少量的KOH,此时中和测得盐酸的浓度数值一定偏高 | |
| D. | 电解饱和食盐水一段时间,若向某一极滴入酚酞试液后溶液呈红色,该极一定是阴极 |
分析 A.石蕊试液在pH值小于5时呈红色,大于8时呈蓝色;甲基橙在pH值小于3.1时呈红色,大于4.4时呈黄色;
B.加入氯化铜后氯离子和铜离子放电;
C.由于氢氧化钠分子量小,所以按氢氧化钠计算会导致氢氧根偏少.最后滴定量就会减多,导致结果偏高;
D.电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,同时电极附近生成氢氧根离子,无色酚酞遇碱变红色,根据电极附近氢氧根离子浓度变化来分析解答.
解答 解:A.石蕊试液在pH值小于5时呈红色,大于8时呈蓝色;甲基橙在pH值小于3.1时呈红色,大于4.4时呈黄色,溶液的pH值:4.4<PH<5,故A正确;
B.加入氯化铜后氯离子和铜离子放电,水不电解,故B错误;
C.因为氢氧化钠的相对分子质量小于氢氧化钾,滴定液的实际氢氧根离子浓度小于要配制的标准溶液的浓度.造成消耗酸的量更少,测定的盐酸溶液浓度的结果比实际的要大,故C正确;
D.电解饱和食盐水时,阳极上氯离子失电子发生氧化反应而生成氯气,阴极上氢离子得电子发生还原反应而生成氢气,同时阴极附近生成氢氧根离子,则阴极附近氢氧根离子浓度增大,无色酚酞遇碱变红色,所以阴极区域溶液先变红色,故D正确.
故选B.
点评 本题考查了常见指示剂石蕊、甲基橙的变色范围、电解原理、溶液配制等,难度较大,注意溶液配制实验中药品不纯对实验结果的影响.

练习册系列答案
相关题目
8.硫代硫酸钠(Na2S2O3)与稀硫酸发生如下反应:Na2S2O3+H2SO4 ═Na2SO4 +SO2 +S↓+H2O,下列四种情况中最早出现浑浊的是( )
| A. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| B. | 20℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| C. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL | |
| D. | 20℃时,0.2mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL |
7.某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出.
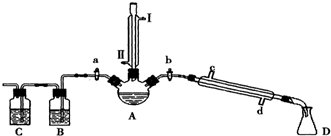
请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.
竖直冷凝管接通冷凝水,进水口是Ⅱ(填“I”或“Ⅱ”);竖直冷凝管的主要作用是冷凝回流.
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等.熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物,已知B、C装置中为常见物质的水溶液.
B装置检验的物质是溴化氢,写出C装置中主要的化学方程式:CH3CH2CH=CH2+Br2→BrCH2CHBrCH2CH3.
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
请你补充下列实验步骤,直到分离出1-溴丁烷.
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭a,打开b;
④接通冷凝管的冷凝水,使冷水从d处流入;
⑤迅速升高温度至101.6℃,收集所得馏分.
(4)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g1-溴丁烷,则1-溴丁烷的产率是0.70.(答案用小数表示,保留2位小数)

请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.
竖直冷凝管接通冷凝水,进水口是Ⅱ(填“I”或“Ⅱ”);竖直冷凝管的主要作用是冷凝回流.
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等.熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物,已知B、C装置中为常见物质的水溶液.
B装置检验的物质是溴化氢,写出C装置中主要的化学方程式:CH3CH2CH=CH2+Br2→BrCH2CHBrCH2CH3.
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭a,打开b;
④接通冷凝管的冷凝水,使冷水从d处流入;
⑤迅速升高温度至101.6℃,收集所得馏分.
(4)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g1-溴丁烷,则1-溴丁烷的产率是0.70.(答案用小数表示,保留2位小数)
4.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标况下,1.12LHCHO含有的电子数为1.5NA | |
| B. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA | |
| D. | 1.0L 0.1 mol•L-1的FeCl3溶液中含有Fe3+数目为0.1NA |
5.下列关于氯水的叙述中,正确的是( )
| A. | 久置的氯水中已没有分子,只有离子 | |
| B. | 新制氯水在光照的条件下,可以产生气体,该气体是氯气 | |
| C. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| D. | 新制氯水可以使干燥的布条褪色 |
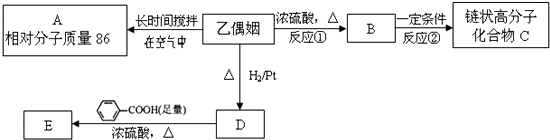
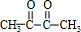
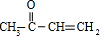 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$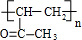
 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$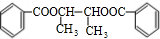 +2H2O.
+2H2O.