题目内容
18.某有机物中含有C、H、O三种元素,其中C、H原子个数比为1:2,标准状况下其蒸气的密度是1.34g/L,将6g该有机物在足量氧气中充分燃烧,产生的高温气体通过足量碱石灰,碱石灰增重12.4g,通过计算确定:(1)该有机物的摩尔质量;
(2)该有机物的分子式.
分析 根据有机物中含有C、H、O三种元素且C、H原子个数比为1:2,设有机物的分子式为CxH2xOy,根据标准状况下蒸气的密度是1.34g/L,可求出其相对分子质量为30,根据相对分子质量来列式:14x+16y=30 ①;
6g该有机物的物质的量为0.2mol,0.2molCxH2xOy燃烧生成0.2xmol二氧化碳和0.2xmol水,均被碱石灰吸收,根据增重12.4g可得:0.2x×44+0.2x×18=12.4 ②
将①②联立可知x=1,y=2,从而确定有机物的分子式.
解答 解:根据有机物中含有C、H、O三种元素且C、H原子个数比为1:2,设有机物的分子式为CxH2xOy.
(1)此有机物标准状况下蒸气的密度是1.34g/L,故其摩尔质量M=ρ•Vm=1.34g/L×22.4L/mol=30g/mol.答:该有机物的摩尔质量为30g/mol.
(2)根据有机物中含有C、H、O三种元素且C、H原子个数比为1:2,设有机物的分子式为CxH2xOy,根据其摩尔质量为30g/mol,即相对分子质量为30,可得列式:14x+16y=30 ①;
6g该有机物的物质的量n=$\frac{6g}{30g/mol}$=0.2mol,而根据C原子和H原子的守恒可知,0.2molCxH2xOy燃烧生成0.2xmol二氧化碳和0.2xmol水,均能被碱石灰吸收,根据碱石灰增重12.4g可得:0.2x×44+0.2x×18=12.4 ②
将①②联立可知x=1,y=2,即有机物的分子式为CH2O.
答:有机物的分子式为CH2O.
点评 本题考查有机物分子式确定和摩尔质量的求算,题目基础性强,贴近教材,有利于基础知识的巩固.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.关于下列实验操作的说明不正确的是( )
| A. | 向某溶液中滴入石蕊呈红色,滴入甲基橙则呈黄色,则该溶液的pH值可能为4.4~5.0 | |
| B. | 电解水时加入H2SO4、NaOH、CuCl2等电解质均可增加导电性,而会使电解水的速率增大 | |
| C. | 配制标准NaOH溶液的NaOH固体含有少量的KOH,此时中和测得盐酸的浓度数值一定偏高 | |
| D. | 电解饱和食盐水一段时间,若向某一极滴入酚酞试液后溶液呈红色,该极一定是阴极 |
12.下表为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)10种元素中,化学性质最不活泼的是Ar;
(2)④②⑤中,最高价氧化物的水化物,碱性最强的碱是KOH;
(3)②④⑦中形成的简单离子,半径由大到小的顺序是S2->K+>Ca2+;
(4)写出①与⑦形成的最简单化合物的电子式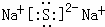 .
.
(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为NaOH+Al(OH)3=Na[Al(OH)4]
(6)试比较与⑦与⑧两种元素最简单氢化物的沸点高低H2O>H2S.
(7)设计一个简单实验证明⑦⑨两种元素非金属性强弱的比较把溴水加到Na2S(或氢硫酸)溶液中,出现淡黄色沉淀;从而证明Br的非金属性强于S的.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)④②⑤中,最高价氧化物的水化物,碱性最强的碱是KOH;
(3)②④⑦中形成的简单离子,半径由大到小的顺序是S2->K+>Ca2+;
(4)写出①与⑦形成的最简单化合物的电子式
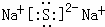 .
.(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为NaOH+Al(OH)3=Na[Al(OH)4]
(6)试比较与⑦与⑧两种元素最简单氢化物的沸点高低H2O>H2S.
(7)设计一个简单实验证明⑦⑨两种元素非金属性强弱的比较把溴水加到Na2S(或氢硫酸)溶液中,出现淡黄色沉淀;从而证明Br的非金属性强于S的.
10.下列说法正确的是( )
| A. | 常温下0.4 mol/L HB溶液与0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c (Na+)>c (B-)>c (H+)>c (OH-) | |
| B. | 常温时,pH均为2的CH3COOH溶液和HCl溶液,pH均为12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等 | |
| C. | 常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2、②NH4Cl、③NH3•H2O、④CH3COONH4中c (NH$_4^+$)由大到小的顺序是:②>①>④>③ | |
| D. | 0.1 mol/L NaHB溶液中其pH为4:c(HB-)>c(H2B)>c(B$_{\;}^{2-}$) |
 ,E原子的价电子排布式为3s23p5,F在周期表中的位置是第四周期第IVB族.
,E原子的价电子排布式为3s23p5,F在周期表中的位置是第四周期第IVB族.

 ;J的结构式
;J的结构式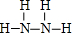 .
.