题目内容
4.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 标况下,1.12LHCHO含有的电子数为1.5NA | |
| B. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA | |
| D. | 1.0L 0.1 mol•L-1的FeCl3溶液中含有Fe3+数目为0.1NA |
分析 A、标况下,甲醛为气体,可以使用气体摩尔体积;
B、苯环不是单双键交替的结构;
C、质量换算物质的量,结合乙烯和丙烯最简式相同金属原子数;
D、Fe3+是弱碱阳离子,在溶液中会水解.
解答 解:A、标况下,甲醛为气体,1.12L甲醛的物质的量为0.05mol,含有的碳原子的物质的量为0.05mol,故A错误;
B、苯环不是单双键交替的结构,故1mol苯乙烯中含1mol双键,即NA个,故B错误;
C、14g乙烯和丙烯的混合物中碳氢比相同,只要计算14gCH2中的原子数即可,14gCH2中的原子数$\frac{14g}{14g/mol}$×NA=3NA个,故C正确;
D、Fe3+是弱碱阳离子,在溶液中会水解,故溶液中Fe3+的个数小0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
12.表示下列变化的化学用语正确的是( )
| A. | 乙烯的分子式:CH2=CH2 | |
| B. | NaHCO3的电离:HCO3-+H2O?H3O++CO32- | |
| C. | NaOH的结构式:Na-O-H | |
| D. | NH4Cl的电子式: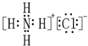 |
13.关于下列实验操作的说明不正确的是( )
| A. | 向某溶液中滴入石蕊呈红色,滴入甲基橙则呈黄色,则该溶液的pH值可能为4.4~5.0 | |
| B. | 电解水时加入H2SO4、NaOH、CuCl2等电解质均可增加导电性,而会使电解水的速率增大 | |
| C. | 配制标准NaOH溶液的NaOH固体含有少量的KOH,此时中和测得盐酸的浓度数值一定偏高 | |
| D. | 电解饱和食盐水一段时间,若向某一极滴入酚酞试液后溶液呈红色,该极一定是阴极 |
12.下表为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)10种元素中,化学性质最不活泼的是Ar;
(2)④②⑤中,最高价氧化物的水化物,碱性最强的碱是KOH;
(3)②④⑦中形成的简单离子,半径由大到小的顺序是S2->K+>Ca2+;
(4)写出①与⑦形成的最简单化合物的电子式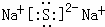 .
.
(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为NaOH+Al(OH)3=Na[Al(OH)4]
(6)试比较与⑦与⑧两种元素最简单氢化物的沸点高低H2O>H2S.
(7)设计一个简单实验证明⑦⑨两种元素非金属性强弱的比较把溴水加到Na2S(或氢硫酸)溶液中,出现淡黄色沉淀;从而证明Br的非金属性强于S的.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)④②⑤中,最高价氧化物的水化物,碱性最强的碱是KOH;
(3)②④⑦中形成的简单离子,半径由大到小的顺序是S2->K+>Ca2+;
(4)写出①与⑦形成的最简单化合物的电子式
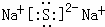 .
.(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为NaOH+Al(OH)3=Na[Al(OH)4]
(6)试比较与⑦与⑧两种元素最简单氢化物的沸点高低H2O>H2S.
(7)设计一个简单实验证明⑦⑨两种元素非金属性强弱的比较把溴水加到Na2S(或氢硫酸)溶液中,出现淡黄色沉淀;从而证明Br的非金属性强于S的.
13.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 100mL 1mol•L-1FeCl3溶液中含阳离子数为0.1NA | |
| B. | 标准状况下,2.24L乙醛完全燃烧所得CO2分子数为0.2NA | |
| C. | 0.6gCaCO3与KHCO3的混合物中所含质子数为0.3NA | |
| D. | 80Ml 10mol•L-1浓盐酸与足量MnO2反应,转移电子数为0.4NA |
14.下列说法不正确的是( )
| A. | 草木灰(含有K2CO3)水溶液可以用于洗涤油污 | |
| B. | 用海沙代替河沙作建房钢筋混凝土材料以节约成本 | |
| C. | 捕获工业排放的CO2能降低地球的温室效应 | |
| D. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
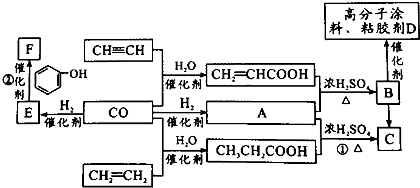
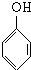 +nHCHO$\stackrel{催化剂}{→}$
+nHCHO$\stackrel{催化剂}{→}$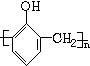 +nH2O.
+nH2O.
 ;J的结构式
;J的结构式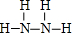 .
. 随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.