题目内容
5.下列关于氯水的叙述中,正确的是( )| A. | 久置的氯水中已没有分子,只有离子 | |
| B. | 新制氯水在光照的条件下,可以产生气体,该气体是氯气 | |
| C. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| D. | 新制氯水可以使干燥的布条褪色 |
分析 由Cl2+H2O?HCl+HClO,可知新制氯水中存在的微粒:三分子:Cl2、HClO、H2O,四离子:H+、Cl-、ClO-、OH-;又因为HClO不稳定,受热或光照时会分解2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,所以久置氯水实际上就是盐酸溶液,其中含有H2O、H+、Cl-、(OH-),是无色的溶液,以此来解答.
解答 解:A、久置的氯水中有水分子,故A错误;
B、HClO不稳定,受热或光照时会分解2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,所以气体是氧气,故B错误;
C、新制氯水中滴加硝酸银溶液,与体系中氯离子结合成难溶的氯化银沉淀,故C错误;
D、新制氯水有次氯酸,次氯酸具有漂白性,可以使干燥的布条褪色,故D正确;
故选D.
点评 本题考查氯水的成分,为高频考点,把握氯气与水的反应及次氯酸的不稳定性为解答的关键,注意新制氯水和久置氯水成分及性质的区别,题目难度不大.

练习册系列答案
相关题目
13.关于下列实验操作的说明不正确的是( )
| A. | 向某溶液中滴入石蕊呈红色,滴入甲基橙则呈黄色,则该溶液的pH值可能为4.4~5.0 | |
| B. | 电解水时加入H2SO4、NaOH、CuCl2等电解质均可增加导电性,而会使电解水的速率增大 | |
| C. | 配制标准NaOH溶液的NaOH固体含有少量的KOH,此时中和测得盐酸的浓度数值一定偏高 | |
| D. | 电解饱和食盐水一段时间,若向某一极滴入酚酞试液后溶液呈红色,该极一定是阴极 |
13.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 100mL 1mol•L-1FeCl3溶液中含阳离子数为0.1NA | |
| B. | 标准状况下,2.24L乙醛完全燃烧所得CO2分子数为0.2NA | |
| C. | 0.6gCaCO3与KHCO3的混合物中所含质子数为0.3NA | |
| D. | 80Ml 10mol•L-1浓盐酸与足量MnO2反应,转移电子数为0.4NA |
20.下列有关常见有机物的说法正确的是( )
| A. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| B. | 油脂都不能使溴的四氯化碳溶液褪色 | |
| C. | 提纯鸡蛋白中的蛋白质时,可向鸡蛋清溶液中加入浓硫酸铵溶液,然后将所得沉淀滤出,经洗涤即得到较纯净的蛋白质 | |
| D. | 石油分馏是化学变化,而煤的干馏为物理变化 |
10.下列说法正确的是( )
| A. | 常温下0.4 mol/L HB溶液与0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c (Na+)>c (B-)>c (H+)>c (OH-) | |
| B. | 常温时,pH均为2的CH3COOH溶液和HCl溶液,pH均为12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等 | |
| C. | 常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2、②NH4Cl、③NH3•H2O、④CH3COONH4中c (NH$_4^+$)由大到小的顺序是:②>①>④>③ | |
| D. | 0.1 mol/L NaHB溶液中其pH为4:c(HB-)>c(H2B)>c(B$_{\;}^{2-}$) |
17.在医院中,为酸中毒病人输液不应采用( )
| A. | 0.9%氯化钠溶液 | B. | 1.25%碳酸氢钠溶液 | ||
| C. | 0.9%氯化铵溶液 | D. | 5%葡萄糖溶液 |
14.下列说法不正确的是( )
| A. | 草木灰(含有K2CO3)水溶液可以用于洗涤油污 | |
| B. | 用海沙代替河沙作建房钢筋混凝土材料以节约成本 | |
| C. | 捕获工业排放的CO2能降低地球的温室效应 | |
| D. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
15.下列物质属于非电解质的是( )
| A. | NaCl | B. | Cu | C. | NaOH | D. | CH3CH2OH |
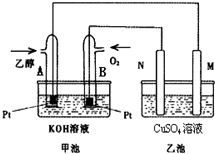 随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.