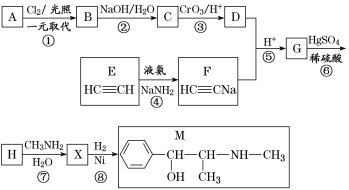
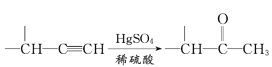
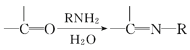
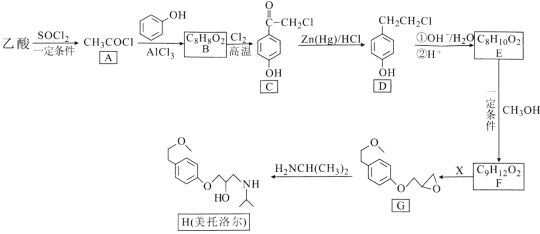
题目内容
【题目】有机物M可从酸牛奶中提取。已知纯净的M为无色黏稠液体, 易溶于水。为研究M的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取4.5 g M,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空:(1)M的摩尔质量为:____ 。 |
(2)将此4.5 g M 在足量纯 O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6 g | (2)M的分子式为:____。 |
(3)1摩尔M 能与足量Na产生1molH2,或与足量NaHCO3产生1molCO2 | (3)写出M中含有的官能团结构简式____ |
(4)M 的核磁共振氢谱如下图:
| (4)M 中含有____种氢原子。 |
(5)综上所述,M 的结构简式为____。 | |
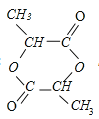
(6)写出两分子M聚合成环状化合物的化学方程式____ | |
(7)写出M发生消去反应的方程式____ | |
【答案】90g/mol C3H6O3 -OH、-COOH 4 ![]()
![]() +
+![]()
![]()
 +2H2O
+2H2O ![]()
![]() CH2=CH-COOH+H2O
CH2=CH-COOH+H2O
【解析】
(1)相同条件下气体密度与摩尔质量成正比,据此可计算出M的摩尔质量;
(2)先计算4.5gM的物质的量,然后浓硫酸增重的质量为水的质量,碱石灰增重的质量为二氧化碳的质量,根据质量守恒定律确定其分子式;
(3)1molM能够与NaHCO3反应放出1molCO2,说明分子中含有1个羧基;1molM能够与Na反应产生1molH2,结合含有的O原子数目可确定分子中还含有1个-OH;
(4)核磁共振氢谱中含有几组吸收峰,则M分子中含有几种H原子;
(5)根据M的分子式、含有官能团及H原子数目确定M的结构简式;
(6)一个M分子中的羟基、羧基分别与另一个分子M的羧基、羟基发生酯化反应形成环酯和水;
(7)M分子中含羟基,与浓硫酸混合加热,发生消去反应形成丙烯酸和水。
(1)称取M 4.5g,升温使其汽化,测其密度是相同条件下H2的45倍,则M的摩尔质量为:M=2g/mol×45=90g/mol;
(2) 4.5gM的物质的量为n=4.5g÷90g/mol=0.05mol,将此4.5gM在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g,说明4.5gM完全燃烧生成水的质量为2.7g,其物质的量为:n(H2O)=2.7g÷18g/mol=0.15mol;生成二氧化碳的质量为6.6g,其物质的量为:n(CO2)=6.6g÷44g/mol=0.15mol;则M分子中含有C、H原子的数目分别为:N(C)=0.15mol÷0.05mol=3、N(H)= (0.15mol×2)÷0.05mol=6,M分子中含有C、H的总原子量为:12×3+1×6=42<90,说明M分子中还含有氧原子,含有氧原子数目为:N(O)=(9042) ÷16=3,所以M的分子式为:C3H6O3;
(3) 1摩尔M 能与足量Na产生1molH2,或与足量NaHCO3产生1molCO2,说明分子中含有1个羧基,1个羟基,官能团的结构简式为-COOH、-OH;
(4)根据M的核磁共振氢谱可知,吸收峰数目为4,则M分子中含有4种H原子;
(5) 根据M的核磁共振氢谱可知,吸收峰数目为4,则M分子中含有4种H原子,4种H原子的个数比为1:1:1:4,说明这四种H原子的个数比为1:1:1:4,则该物质的结构简式为![]() ;
;
(6)两分子M的官能团发生酯化反应形成环酯和水,反应方程式为![]() +
+![]()
![]()
 +2H2O;
+2H2O;
(7)M分子中含有醇羟基,由于羟基连接的C原子的邻位C原子上有H原子,因此可以与浓硫酸混合加热,发生消去反应产生丙烯酸CH2=CH-COOH和水,反应的方程式为:![]()
![]() CH2=CH-COOH+H2O。
CH2=CH-COOH+H2O。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
| ① | 0.2molL-1盐酸 | 产生黄绿色气体 |
② | 0.2molL-1KI-淀粉溶液 | 溶液变蓝 | |
③ | 0.2molL-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
④ | 0.2molL-1AlCl3溶液 | 产生白色沉淀 | |
下列判断不正确的是
A.实验①中发生的反应:ClO-+Cl-+2H+=Cl2↑+H2O
B.实验②中发生的反应:ClO-+2I-+2H+=Cl-+I2+H2O
C.实验③中该条件下氧化性强弱:ClO->Fe3+
D.实验④中ClO-与Al3+相互促进水解