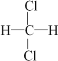
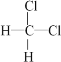
题目内容
【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
| ① | 0.2molL-1盐酸 | 产生黄绿色气体 |
② | 0.2molL-1KI-淀粉溶液 | 溶液变蓝 | |
③ | 0.2molL-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
④ | 0.2molL-1AlCl3溶液 | 产生白色沉淀 | |
下列判断不正确的是
A.实验①中发生的反应:ClO-+Cl-+2H+=Cl2↑+H2O
B.实验②中发生的反应:ClO-+2I-+2H+=Cl-+I2+H2O
C.实验③中该条件下氧化性强弱:ClO->Fe3+
D.实验④中ClO-与Al3+相互促进水解
【答案】B
【解析】
A.加入盐酸,次氯酸根离子在酸溶液中具有强氧化性氧化氯离子生成氯气,反应的离子方程式:ClO-+Cl-+2H+=Cl2↑+H2O,故A正确;
B.实验②0.2molL-1KI-淀粉溶液中滴入次氯酸钠溶液,发生的反应是碱性溶液中次氯酸钠氧化碘化钾生成碘单质,反应的离子方程式:ClO-+2I-+H2O=Cl-+I2+2OH-,故B错误;
C.在0.2mol/LFeSO4酸性溶液中滴加0.2mol/LNaClO溶液,Fe2+和ClO-发生氧化反应生成的Fe3+遇KSCN,使溶液显红色,即说明Fe2+还原性大于Cl-,故C正确;
D.NaClO溶液水解显碱性,AlCl3溶液水解显酸性,二者混合相互促进水解,生成Al(OH)3白色胶状沉淀,故D正确;
故选B。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:
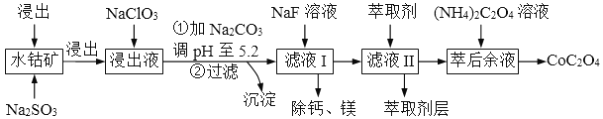
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等; ②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:______________。
(2)浸出液中加入NaClO3的目的是____________________________。
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是_____(填化学式)。
(4)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是______;其使用的适宜pH范围是___。
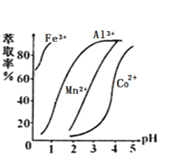
A.2.02.5 B.3.03.5 C.4.04.5
(5)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。己知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量 NaF后,所得滤液 c(Mg2+)/c(Ca2+) =____________。
【题目】有机物M可从酸牛奶中提取。已知纯净的M为无色黏稠液体, 易溶于水。为研究M的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取4.5 g M,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空:(1)M的摩尔质量为:____ 。 |
(2)将此4.5 g M 在足量纯 O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6 g | (2)M的分子式为:____。 |
(3)1摩尔M 能与足量Na产生1molH2,或与足量NaHCO3产生1molCO2 | (3)写出M中含有的官能团结构简式____ |
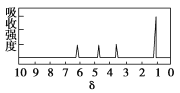
(4)M 的核磁共振氢谱如下图:
| (4)M 中含有____种氢原子。 |
(5)综上所述,M 的结构简式为____。 | |
(6)写出两分子M聚合成环状化合物的化学方程式____ | |
(7)写出M发生消去反应的方程式____ | |