题目内容
【题目】常温下,在20mL0.lmol/LNa2CO3溶液中逐滴加入40mL0.l mol/L 稀盐酸,溶液中含碳元素各种微粒(CO2因逸出未画出)的物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法正确的是

A.曲线a表示H2CO3的变化曲线
B.H2CO3、HCO3-、CO32-可大量共存于同一溶液中
C.pH=11时,c(HCO3-)>c(Cl-)
D.碳酸钠溶液的水解平衡常数为1.0×10-11
【答案】C
【解析】
随着酸液的加入,含碳组分a逐渐减少,含碳组分b逐渐增多,此时发生反应![]() ,则a代表碳酸根离子,b代表碳酸氢根离子,c为碳酸分子。
,则a代表碳酸根离子,b代表碳酸氢根离子,c为碳酸分子。
A. 根据分析,a代表碳酸根离子,c为碳酸分子,A错误;
B. H2CO3和CO32-会发生反应![]() ,无法大量共存,B错误;
,无法大量共存,B错误;
C. 当不考虑盐类水解时,需要以2:1的比例向碳酸钠中加入盐酸,会实现![]() ,此时
,此时![]() ,但是由于存在盐类水解,且碳酸根离子的水解能力特别强,故不需要加入那么多盐酸即可实现
,但是由于存在盐类水解,且碳酸根离子的水解能力特别强,故不需要加入那么多盐酸即可实现![]() ,此时
,此时![]() ,C正确;
,C正确;
D. 碳酸钠溶液的水解平衡常数的计算公式为![]() ,可选取图像中pH=11的点,此时
,可选取图像中pH=11的点,此时![]() ,故
,故![]() ,故D错误;
,故D错误;
故答案选C。

【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等; ②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:______________。
(2)浸出液中加入NaClO3的目的是____________________________。
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是_____(填化学式)。
(4)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是______;其使用的适宜pH范围是___。

A.2.02.5 B.3.03.5 C.4.04.5
(5)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。己知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量 NaF后,所得滤液 c(Mg2+)/c(Ca2+) =____________。
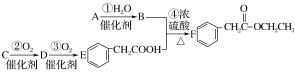
【题目】有机物M可从酸牛奶中提取。已知纯净的M为无色黏稠液体, 易溶于水。为研究M的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取4.5 g M,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空:(1)M的摩尔质量为:____ 。 |
(2)将此4.5 g M 在足量纯 O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6 g | (2)M的分子式为:____。 |
(3)1摩尔M 能与足量Na产生1molH2,或与足量NaHCO3产生1molCO2 | (3)写出M中含有的官能团结构简式____ |
(4)M 的核磁共振氢谱如下图:
| (4)M 中含有____种氢原子。 |
(5)综上所述,M 的结构简式为____。 | |
(6)写出两分子M聚合成环状化合物的化学方程式____ | |
(7)写出M发生消去反应的方程式____ | |