题目内容
【题目】汽车尾气中的NO(g) 是导致光化学烟雾和破坏臭氧层的重要源头之一。现拟用下列方法处理NO,根据题意回答下列问题:
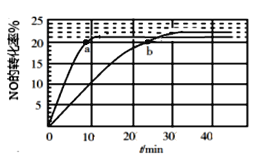
(1)采用某种催化剂催化分解NO,发生反应2NO(g)![]() N2(g)+O2(g),在T1℃ 和T2℃时(T1>T2)NO的转化率随时间变化的结果如图所示。
N2(g)+O2(g),在T1℃ 和T2℃时(T1>T2)NO的转化率随时间变化的结果如图所示。
① 反应 2NO(g)![]() N2(g)+O2(g) 为(填“吸热”或“放热”)____________反应。
N2(g)+O2(g) 为(填“吸热”或“放热”)____________反应。
② T2℃时,反应的平衡常数K=__________(保留2位小数)。
③ 在T1℃下,要提高NO转化率,可采取的措施是_________________________
④ 比较a、b处反应速率大小:va(正)________ vb(逆)(填“大于”“小于”或“等于”)。已知反应速率 v正=k正x2(NO),v逆=k逆 x(N2)·x(O2),k正、k逆 分别为正、逆向反应速率常数,x为物质的量分数,计算b点处v(正)/v(逆)=__________(保留1位小数)。
(2)臭氧也可用于处理NO.O3氧化NO结合水洗可产生HNO3和O2,写出该反应的化学方程式___________________,每生成1mol的HNO3转移_______mol电子.
【答案】放热 0.02 移走生成物 大于 1.3 3O3+2NO+H2O═2HNO3+3O2 3
【解析】
(1) ①根据图像分析,温度越高,化学反应速率越快,越先达到平衡,从图像看出温度高时NO转化率低,所以反应 2NO(g)![]() N2(g)+O2(g)为放热反应;
N2(g)+O2(g)为放热反应;
② T2℃时,根据图像可以知道NO的平衡转化率为22%,三行式法计算平衡常数;
③温度一定时,可减少生成物浓度,平衡正向移动,提高转化率;压强对此反应无影响;
④温度越高,化学反应速率越快,比较a、b处反应速率大小;根据平衡常数计算 k正、k逆的关系,再根据b点计算v(正)/v(逆);
(2)O3氧化NO结合水洗可产生HNO3和O2,写出化学方程式;O3氧化NO结合水洗可产生HNO3和O2,转移电子数=化合价升高数,NO转化为HNO3 ,化合价升高3,每生成1mol的HNO3转移3mol电子。
(1) ①根据图像分析,温度越高,化学反应速率越快,越先达到平衡,从图像看出温度高时NO转化率低,所以反应 2NO(g)![]() N2(g)+O2(g)为放热反应;
N2(g)+O2(g)为放热反应;
正确答案:放热反应。
② T2℃时,根据图像可以知道NO的平衡转化率为22%,三行式法计算平衡常数;
2NO(g)![]() N2(g)+O2(g)
N2(g)+O2(g)
C(初) 1 0 0
△C 0.22 0.11 0.11
C(末) 0.78 0.11 0.11
K=![]() ≈0.02;
≈0.02;
正确答案:0.02。
③温度一定时,可减少生成物浓度,平衡正向移动,提高转化率;压强对此反应无影响;
正确答案:移走生成物。
④温度越高,化学反应速率越快,所以va(正)大于vb(逆);根据平衡常数计算 k正、k逆的关系,再根据b点计算v(正)/v(逆);
T2℃时,平衡时v(正)= v(逆), 即k正x2(NO)平衡 =k逆 x(N2)平衡·x(O2)平衡,得k (正)/ k (逆)= x(N2)平衡·x(O2)平衡/ x2(NO)平衡=K=0.02(提示:前面计算所得);
b点时NO转化率为20%,列三行式
2NO(g)![]() N2(g)+O2(g)
N2(g)+O2(g)
C(初) 1 0 0
△C 0.20 0.10 0.10
C(末) 0.80 0.10 0.10
b点处v(正)/v(逆)= k正x2(NO)/ (k逆 x(N2)·x(O2))=![]() ×
×![]() =0.02×64=1.3
=0.02×64=1.3
正确答案: 大于 1.3。
(2) O3氧化NO结合水洗可产生HNO3和O2,写出化学方程式3O3+2NO+H2O═2HNO3+3O2;O3氧化NO结合水洗可产生HNO3和O2,转移电子数=化合价升高数,NO转化为HNO3 ,化合价升高3,每生成1mol的HNO3转移3mol电子。
正确答案:3O3+2NO+H2O═2HNO3+3O2 3。