题目内容
【题目】工业酸性废水中的![]() 可转化为
可转化为![]() 除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为
除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为![]() 的起始浓度、电压、电解时间均相同),下列说法中,不正确的是( )
的起始浓度、电压、电解时间均相同),下列说法中,不正确的是( )
实验 | ① | ② | ③ |
电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨,滴加 | 阴极为石墨,阳极为铁,滴加 |
| 0.922 | 12.7 | 57.3 |
A. 对比实验①②可知,降低pH可以提高![]() 的去除率
的去除率
B. 实验②中,![]() 在阴极放电的电极反应式是
在阴极放电的电极反应式是![]()
C. 实验③中,![]() 去除率提高的原因是阳极产物还原
去除率提高的原因是阳极产物还原![]()
D. 实验③中,理论上电路中每通过![]() 电子,则有
电子,则有![]()
![]() 被还原
被还原
【答案】D
【解析】
A.对比实验①②,这两个实验中只有溶液酸性强弱不同,其它外界因素都相同,且溶液的pH越小,Cr2O72-的去除率越大;
B.实验②中,Cr2O72-在阴极上得电子发生还原反应;
C.实验③中,Cr2O72-在阴极上得电子,阳极上生成的亚铁离子也能还原Cr2O72-;
D.实验③中,Cr2O72-在阴极上得电子,阳极上生成的亚铁离子也能还原Cr2O72-,理论上电路中每通过3 mol电子,则有0.5 molCr2O72-在阴极上被还原,且溶液中还有Cr2O72-被还原。
A.对比实验①②,这两个实验中只有溶液酸性强弱不同,其它外界因素都相同,且溶液的pH越小,Cr2O72-的去除率越大,所以降低pH可以提高Cr2O72-的去除率,A正确;
B.实验②中,Cr2O72-在阴极上得电子发生还原反应,电极反应式为Cr2O72-+6e-+14H+=2Cr3++7H2O,故B正确;
C.实验③中,Cr2O72-在阴极上得电子,阳极上Fe失电子生成Fe2+,亚铁离子也能还原Cr2O72-,C正确;
D.实验③中,Cr2O72-在阴极上得电子,阳极上Fe失电子生成Fe2+,亚铁离子也能还原Cr2O72-,理论上电路中每通过3mol电子,根据电极反应式Cr2O72-+6e-+14H+=2Cr3++7H2O,则有0.5 molCr2O72-在阴极上被还原,同时阳极生成1.5molFe2+,根据得失电子守恒,溶液中还有0.25mol Cr2O72-被Fe2+还原,所以共有0.75mol Cr2O72-被还原,D错误;
故合理选项是D。

 名校课堂系列答案
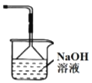
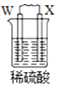
名校课堂系列答案【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲 | 乙 | 丙 | |
装置 |
|
|
|
现象 | 金属W不断溶解 | Y 的质量增加 | W上有气体产生 |
A.四种金属的活动性强弱顺序为Z>W>Y>X
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置甲中X作原电池正极
D.装置丙中溶液的c(H+)减小