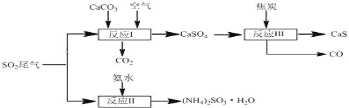
题目内容
【题目】锌与100mL18.5mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的c(H+)=0.1mol·L-1。请计算:
(1)反应中共消耗H2SO4的物质的量为__。
(2)反应中共消耗Zn的质量为__。
(3)气体的成分及物质的量之比为__。
【答案】1.8mol 97.5g V(SO2):V(H2)=1:4
【解析】
Zn和浓硫酸发生:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,随着反应的进行,溶液浓度减小,稀硫酸与Zn发生:Zn+H2SO4(稀)=ZnSO4+H2↑,则生成的气体为SO2和的H2混合物,根据反应的有关方程式结合质量守恒定律列方程组计算。
(1)生成气体的物质的量为![]() =1.5mol,溶液剩余硫酸的物质的量为
=1.5mol,溶液剩余硫酸的物质的量为![]() ×1L×0.1mol/L=0.05mol,参加反应的n(H2SO4)=0.1L×18.5mol/L0.05mol=1.8mol;
×1L×0.1mol/L=0.05mol,参加反应的n(H2SO4)=0.1L×18.5mol/L0.05mol=1.8mol;
(2)参加反应的n(H2SO4)=1.8mol,随着反应的进行,硫酸的浓度逐渐减小,
设反应生成xmolSO2,ymolH2,
![]()
![]()
![]() ,解得x=0.3,y=1.2,反应中共消耗金属Zn的质量m(Zn)=(0.3mol+1.2mol)×65g/mol=97.5g;
,解得x=0.3,y=1.2,反应中共消耗金属Zn的质量m(Zn)=(0.3mol+1.2mol)×65g/mol=97.5g;
(3)由(2)分析可知,气体A为SO2和H2的混合物,且V(SO2):V(H2)=1:4。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】液氨作为一种潜在的清洁汽车燃料,它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。请回答下列问题:
Ⅰ.已知反应N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea1=akJ/mol,相关化学键键能数据如下:
2NH3(g)的活化能Ea1=akJ/mol,相关化学键键能数据如下:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | 436 | 946 | 391 |
(1)反应2NH3(g)![]() N2(g)+3H2(g)的活化能Ea2=______kJ/mol(用含a的代数式表示);
N2(g)+3H2(g)的活化能Ea2=______kJ/mol(用含a的代数式表示);
(2)已知:
① 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
② 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③ 4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
则△H1、△H2、△H3三者之间的关系为:△H3= ______________ ;
Ⅱ.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,工作原理如图所示。
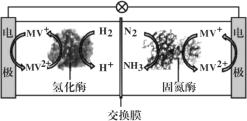
(3)负极的电极反应式为_______________;
(4)当电路中通过3mol电子时,可产生氨气的体积(标况下)为_______L;正极区中n(H+)______(填“增加”、“减少”或“不变”);
(5)该装置在高温下不能正常工作,原因是_____。
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在_____________________范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为_____________________________________________________________。
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为_________________________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为_________。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-=2Fe2++I2 2S2O32-+I2=2I-+S4O62-
则溶液中铁元素的总含量为_________g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会_______ (填“偏高” “偏低” “不变”)
【题目】一定温度下,在2 L的密闭容器中发生反应:xA(g)+B(g)![]() 2C(g) ΔH<0,A、C的物质的量随时间变化的关系如下表所示。下列有关说法正确的是( )
2C(g) ΔH<0,A、C的物质的量随时间变化的关系如下表所示。下列有关说法正确的是( )
时间/min | n(A)/mol | n(C)/mol |
0 | 0.3 | 0 |
1 | 0.15 | 0.15 |
2 | 0.1 | 0.2 |
3 | 0.1 | 0.2 |
A.x=1
B.反应开始2 min内,用B表示的反应速率为0.05 mol·L-1·min-1
C.反应进行到1 min时,反应体系达到化学平衡状态
D.A的正反应速率等于C的逆反应速率时,反应体系达到化学平衡状态