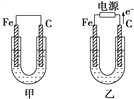
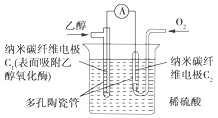
题目内容
【题目】一定温度下,在2 L的密闭容器中发生反应:xA(g)+B(g)![]() 2C(g) ΔH<0,A、C的物质的量随时间变化的关系如下表所示。下列有关说法正确的是( )
2C(g) ΔH<0,A、C的物质的量随时间变化的关系如下表所示。下列有关说法正确的是( )
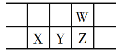
时间/min | n(A)/mol | n(C)/mol |
0 | 0.3 | 0 |
1 | 0.15 | 0.15 |
2 | 0.1 | 0.2 |
3 | 0.1 | 0.2 |
A.x=1
B.反应开始2 min内,用B表示的反应速率为0.05 mol·L-1·min-1
C.反应进行到1 min时,反应体系达到化学平衡状态
D.A的正反应速率等于C的逆反应速率时,反应体系达到化学平衡状态
【答案】D
【解析】
A.1~2 min内,Δn(A)∶Δn(C)=x∶2=(0.15-0.1)∶(0.2-0.15),x=2,A错误;
B.反应开始2 min内,v(B)=![]() v(C)=
v(C)=![]() ×
×![]() =0.025 mol·L-1·min-1,B错误;
=0.025 mol·L-1·min-1,B错误;
C.表中数据表明,1 min后,A、C的物质的量还在改变,说明反应进行到1 min时,反应体系还未达到化学平衡状态,C错误;
D.因A、C的化学计量数相等,当v(A)正=v(C)逆时,反应体系达到化学平衡状态,D正确。
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】在101 kPa时,氢气在1.0 mol氧气中完全燃烧,生成2.0 mol液态水,放出571.6 kJ的热量,氢气的标准燃烧热ΔH为____,表示氢气标准燃烧热的热化学方程式为________
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,在CO2中通入H2,二者可发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
(1)反应Ⅰ的化学平衡常数表达式是K=_______________________________。
(2)一定温度下,在容积可变的密闭容器中进行反应Ⅱ,不能确定上述可逆反应已达到化学平衡状态的是_____________
A.体系的体积不再发生变化 B.生成n mol CO的同时消耗n mol H2O
C.混合气的密度不再改变 D.1 mol H—H键断裂的同时断裂2 mol H—O键
(3)某实验室控制一定的CO2和H2初始投料比,在相同压强下,经过相同的反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
反应序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
① | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
② | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
③ | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
④ | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
①对比表中①和③可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因________________________________;
②对比表中①、②可发现,在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因___________________________________________。
③有利于提高CO2转化为CH3OH平衡转化率的措施有____________。
a.使用Cu/ZnO纳米棒做催化剂 b.使用Cu/ZnO纳米片做催化剂
c.降低反应温度 d.投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
(4)反应混合气体经过降温加压可分离出甲醇,剩余气体可再次充入反应器继续反应,经过多次循环往复后混合气体中CO的含量已经很高,可以在另外容器中在合适的催化剂条件下使CO和H2反应合成CH3OH(g),写出该反应的热化学方程式:_______________________________。