题目内容
【题目】在恒容恒温的密闭容器中充入1molX和2molY,发生反应:
X(g)+2Y(g)![]() 2Z(g)+M(s) △H=-akJ/mol(a>0),下列说法正确的是
2Z(g)+M(s) △H=-akJ/mol(a>0),下列说法正确的是
A. 当v正(X) = v逆(M),说明反应达到平衡状态
B. 达到化学平衡状态时,反应放出的总热量为akJ
C. 反应达到平衡时,X和Y的转化率相等
D. 降低反应温度,正反应速率增大,逆反应速率减小
【答案】C
【解析】M为固体,其浓度在反应过程中不变,故不能用其表示该反应的化学反应速率。该反应为可逆反应,反应物不能完全转化为生成物,故达到化学平衡状态时,反应放出的总热量小于akJ。反应物的起始量和变化量均等于化学计量数之比,故当反应达到平衡时,X和Y的转化率相等。降低反应温度,正反应速率减小,逆反应速率也减小。
A. M为固体,其浓度在反应过程中不变,故不能用其表示该反应的化学反应速率,A不正确;
B. 该反应为可逆反应,反应物不能完全转化为生成物,故达到化学平衡状态时,反应放出的总热量小于akJ,B不正确;
C. 反应物的起始量和变化量均等于化学计量数之比,故当反应达到平衡时,X和Y的转化率相等,C正确;
D. 降低反应温度,正反应速率减小,逆反应速率也减小,D不正确。
本题选C。

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
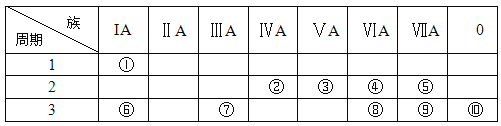
三新快车金牌周周练系列答案【题目】现有6种短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
W | 周期表中原子半径最小的元素 |
U | 地壳中含量最多的金属元素 |
R | 单质为空气的主要成分 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
完成下列空白(涉及W、U、R、T、X、Y、Z时,用元素符号表示):
(1)元素T的原子共有__个电子;元素X的一种核素可测定文物年代,这种核素的符号是___。
(2)用电子式表示:
①气态化合物XR2_______;
②元素W、R形成的10电子分子的形成过程_____________。
(3)用离子方程式表示:
①元素Y与元素W形成的离子YW4+与NaOH溶液共热的反应_____;
②元素U的单质与NaOH溶液反应_______。
(4)元素Z与元素T相比,非金属性较强的是___,下列表述中能证明这一事实的是___(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(5)探寻物质的性质差异性是学习的重要方法之一。在T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种的是____(用分子式表示),理由是_________。