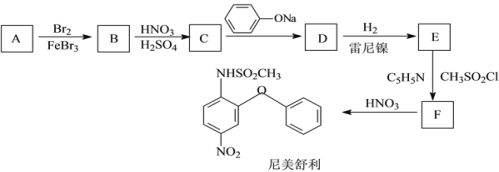
题目内容
【题目】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
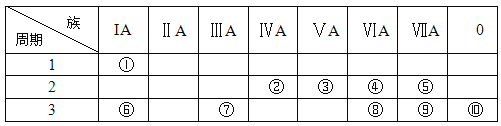
(1)非金属性最强的是______(填元素符号),化学性质最不活泼的是_____(填元素符号)。
(2)由①、④、⑥、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是_____________。(填化学式)
(4)表中能形成两性氢氧化物的元素是_________(填元素符号),分别写出该元素的氢氧化物与⑥、⑧最高价氧化物的水化物反应的离子方程式:___________________,_________________________。
(5)请设计一个实验方案,比较④、⑧单质氧化性的强弱,并描述现象和结论:___________________。
【答案】(14分)
(1)F、 Ar (2)![]() 或
或![]() (3)HClO4 >HNO3 >H2CO3
(3)HClO4 >HNO3 >H2CO3
(4)Al Al(OH)3+OH-=AlO2- +H2O, Al(OH)3+3H+= Al3++3H2O
(5)向H2S溶液中通入O2,溶液出现浑浊,说明O2的氧化性比S更强
【解析】
由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Al、⑧为S、⑨为Cl、⑩为Ar,结合元素周期律分析解答。
由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Al、⑧为S、⑨为Cl、⑩为Ar。
(1)同一周期,从左向右,非金属性增强;同一主族,从上到下,非金属性减弱。非金属性最强的元素为F;零族元素Ar的化学性质最不活泼,故答案为:F;Ar;
(2)由H、O、Na、Cl中的某些元素可形成既含离子键又含极性共价键的化合物,该化合物可以是氢氧化钠、次氯酸钠等,电子式为![]() 或
或![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
(3)②为C、③为N、⑨为Cl,碳酸为弱酸,硝酸为强酸,高氯酸是最强的无机含氧酸,故酸性HClO4>HNO3>H2CO3,故答案为:HClO4>HNO3>H2CO3;
(4)氢氧化铝为两性氢氧化物,能形成两性氢氧化物的元素是铝;氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-=AlO2-+2H2O,氢氧化铝与硫酸反应生成硫酸铝和水,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,故答案为:Al;Al(OH)3+OH-=AlO2-+2H2O;Al(OH)3+3H+=Al3++3H2O;
(5)比较S和O的单质氧化性的强弱,可以通过氧气与硫化物的置换反应实现,实验方案为:向H2S溶液中通入O2,溶液出现浑浊,说明O2的氧化性比S更强,故答案为:向H2S溶液中通入O2,溶液出现浑浊,说明O2的氧化性比S更强。

 名校课堂系列答案
名校课堂系列答案【题目】土法酿造葡萄酒(只加糖的纯天然酿酒法)容易出问题,有报道说,喝了自制葡萄酒差点失明。主要原因是发酵过程产生的菌种多达百种,难以控制,而产生对神经有毒的甲醇等物质。科学酿酒加SO2等辅料,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。
(1)葡萄酒中添加SO2的作用可能是________。
A.氧化细菌 B.抗氧化 C.漂白 D.增酸作用
I.实验方案一
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如图1的实验:
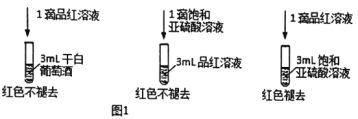
(2)甲同学得出的实验结论是干白葡萄酒中不含SO2或H2SO3。这个结论____(填“成立”或“不成立”),理由是______。
Ⅱ.实验方案二
(3)用如图实验装置探究二氧化硫的氧化性。
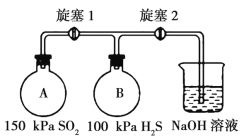
充入气体前的操作为___,关闭旋塞1和2;按图2充入气体,连接装置。打开旋塞1,可观察到的主要现象是_____;若A瓶和B瓶的体积相等,恢复到常温,打开旋塞2,可观察到的现象是____,此时A瓶中可能发生反应的化学方程式为____。
(4)从环保角度,利用图2装置设计探究二氧化硫既有氧化性又有还原性的最佳方案。
实验方案 | 预期现象 |
将烧杯中的氢氧化钠溶液换成_____溶液(填化学式),操作如(3) | 说明SO2具有还原性的现象为____,对应的离子方程式为:_____________________ |