题目内容
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)元素名称:A______B______C______D______
(2)D元素位于周期表中第______周期第______族.C2B2的电子式:_________,所含化学键类型______________。
(3)AB2的电子式:___________写出AB2与C2B2反应的化学方程式____________________。
(4)画出B的原子结构示意图_____________。
(5)用电子式表示化合物C2D的形成过程:_____________________
【答案】 碳 氧 钠 硫 三 ⅥA ![]() 离子键和共价键
离子键和共价键 ![]() 2CO2+2Na2O2=2Na2CO3+O2↑
2CO2+2Na2O2=2Na2CO3+O2↑ ![]()
![]()
【解析】根据元素的相关信息结合元素的核外电子排布以及元素在周期表中的相对位置首先判断出元素种类,然后结合题干问题以及单质及其化合物的性质分析解答。
有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,则A是碳元素,C在空气中燃烧时呈现黄色火焰,C是Na。C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,所以B是氧元素,D是硫元素,则
(1)根据以上分析可知四种元素的名称分别是碳、氧、钠、硫;(2)S元素的原子序数是16,位于周期表中第三周期第ⅥA族;过氧化钠是离子化合物,电子式为![]() ,所含化学键类型有离子键和非极性键;(3)CO2是共价化合物,电子式为
,所含化学键类型有离子键和非极性键;(3)CO2是共价化合物,电子式为![]() ;CO2与过氧化钠反应的化学方程式为 2CO2+2Na2O2=2Na2CO3+O2↑;(4)氧元素的原子序数是8,其原子结构示意图为
;CO2与过氧化钠反应的化学方程式为 2CO2+2Na2O2=2Na2CO3+O2↑;(4)氧元素的原子序数是8,其原子结构示意图为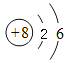 ;(5)硫化钠是离子化合物,其形成过程可以表示为
;(5)硫化钠是离子化合物,其形成过程可以表示为![]() 。
。
