题目内容
【题目】现有6种短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
W | 周期表中原子半径最小的元素 |
U | 地壳中含量最多的金属元素 |
R | 单质为空气的主要成分 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
完成下列空白(涉及W、U、R、T、X、Y、Z时,用元素符号表示):
(1)元素T的原子共有__个电子;元素X的一种核素可测定文物年代,这种核素的符号是___。
(2)用电子式表示:
①气态化合物XR2_______;
②元素W、R形成的10电子分子的形成过程_____________。
(3)用离子方程式表示:
①元素Y与元素W形成的离子YW4+与NaOH溶液共热的反应_____;
②元素U的单质与NaOH溶液反应_______。
(4)元素Z与元素T相比,非金属性较强的是___,下列表述中能证明这一事实的是___(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(5)探寻物质的性质差异性是学习的重要方法之一。在T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种的是____(用分子式表示),理由是_________。
【答案】16 ![]()
![]()
![]() NH4++OH-
NH4++OH-![]() NH3↑+H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑ Cl b H2CO3 H2CO3是弱酸性(或非氧化性酸)
NH3↑+H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑ Cl b H2CO3 H2CO3是弱酸性(或非氧化性酸)
【解析】
W是周期表中原子半径最小的元素,故W为氢;地壳中含量最多的金属元素为铝,故U为铝;R单质为空气的主要成分,即R为O元素;T的M层上有6个电子,故T为硫;X的最外层电子数是次外层电子数的2倍,故X为碳;Y的氢化物水溶液呈碱性,故Y为氮元素;Z元素最高正价是+7价,故Z为Cl元素,据此进行解答。
根据上述分析可知,W为H元素,U为Al元素;R为O元素,T为S元素,X为C元素,Y为N元素,Z为Cl元素,则
(1)元素T为S,其原子核外共有16个电子,元素C的一种核素可测定文物年代,中子数比质子数多2,这种核素的符号为![]() ,
,
故答案为:16;![]() ;
;
(2)①气态化合物XR2为CO2,为共价化合物,分子内各原子均满8电子结构,其电子式为:![]() ,
,
故答案为:![]() ;
;
②元素W、R形成的10电子分子为水,用电子式表示的形成过程为:![]() ,
,
故答案为:![]() ;
;
(3)①元素N与元素H形成的离子NH4+与NaOH溶液共热反应生成氨气和水,离子反应方程式为:NH4++OH-![]() NH3↑+H2O,
NH3↑+H2O,
故答案为:NH4++OH-![]() NH3↑+H2O;
NH3↑+H2O;
②元素Al的单质与NaOH溶液反应生成偏铝酸钠和氢气,离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)元素Cl与元素S相比,非金属性较强的是Cl,
a.常温下Z的单质和T的单质状态不同,状态与非金属性无关,a项错误;
b.Z的氢化物比T的氢化物稳定,气态氢化物越稳定,说明非金属性越强,b项正确;
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应,都能反应,不能说明强弱,c项错误,
综上所述,b项正确,
故答案为:Cl;b;
(5)T、X、Y、Z四种元素的最高价氧化物对应水化物分别为H2SO4、H2CO3、HNO3、HClO4,H2CO3是弱酸,其余均为强酸,
故答案为:H2CO3;H2CO3是弱酸性(或非氧化性酸)。

 应用题作业本系列答案
应用题作业本系列答案【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
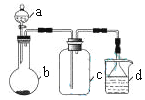
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
【题目】土法酿造葡萄酒(只加糖的纯天然酿酒法)容易出问题,有报道说,喝了自制葡萄酒差点失明。主要原因是发酵过程产生的菌种多达百种,难以控制,而产生对神经有毒的甲醇等物质。科学酿酒加SO2等辅料,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。
(1)葡萄酒中添加SO2的作用可能是________。
A.氧化细菌 B.抗氧化 C.漂白 D.增酸作用
I.实验方案一
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如图1的实验:
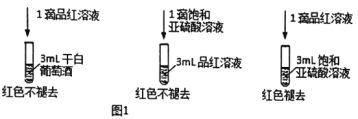
(2)甲同学得出的实验结论是干白葡萄酒中不含SO2或H2SO3。这个结论____(填“成立”或“不成立”),理由是______。
Ⅱ.实验方案二
(3)用如图实验装置探究二氧化硫的氧化性。
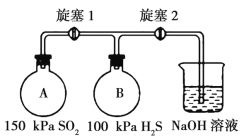
充入气体前的操作为___,关闭旋塞1和2;按图2充入气体,连接装置。打开旋塞1,可观察到的主要现象是_____;若A瓶和B瓶的体积相等,恢复到常温,打开旋塞2,可观察到的现象是____,此时A瓶中可能发生反应的化学方程式为____。
(4)从环保角度,利用图2装置设计探究二氧化硫既有氧化性又有还原性的最佳方案。
实验方案 | 预期现象 |
将烧杯中的氢氧化钠溶液换成_____溶液(填化学式),操作如(3) | 说明SO2具有还原性的现象为____,对应的离子方程式为:_____________________ |