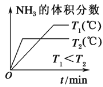
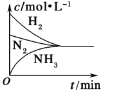
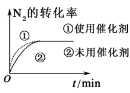
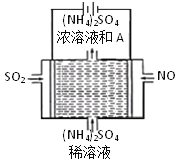
题目内容
【题目】工业废气H2S经资源化利用后可回收能量并得到单质硫。反应原理为2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1。H2S燃料电池的工作原理如图所示。下列有关说法不正确的是( )

A.电极a为电池的负极
B.电极b上的电极反应式为O2+4H++4e-===2H2O
C.若电路中通过2 mol电子,则电池内部释放632 kJ热能
D.若有17 g H2S参与反应,则会有1 mol H+经质子膜进入正极区
【答案】C
【解析】
根据2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1,得出负极H2S失电子发生氧化反应 正极O2得电子发生还原反应,据此分析解
A.由2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1,得出负极H2S失电子发生氧化反应,则a 为电池的负极,故A正确;
B.正极O2得电子发生还原反应,所以电极 b上发生的电极反应为 O2+4H++4e-=2H2O,故B正确;
C.电路中每流过2mol电子,则消耗0.5mol 氧气,但该装置将化学能转化为电能,所以电池内部几乎不放出能量,故C错误;
D.每17g即0.5molH2S参与反应,则消耗 0.25mol氧气,则根据 O2+4H++4e-=2H2O,所以有1moH+经 质子膜进入正极区,故D正确;
故选C 。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】已知常温下浓度为0.lmol/L的下列溶液的pH如下表,下列有关说法正确的是( )
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序: H2CO3< HClO<HF
B.向上述NaC1O溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>(H+)>c(HClO) >c(OH-)
C.根据上表,水解方程式ClO-+H2O![]() HClO+OH-的水解常数K=10-7.6
HClO+OH-的水解常数K=10-7.6
D.若将CO2通入0.lmol/LNa2CO3溶液中至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol/L
【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 酒精溶液滴入高锰酸钾溶液中 | 石蕊溶液滴入氯水中 |
| 常温下,铝片插入浓硫酸中 |
现象 | 高锰酸钾溶液褪色 | 溶液变红,随后迅速褪色 | 沉淀由黄色逐渐变为黑色 | 无明显现象 |
A.AB.BC.CD.D