题目内容
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2![]() 在空气中存在下列平衡:2NO(g)+O2(g)
在空气中存在下列平衡:2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1,2SO2(g)+O2(g)
2NO2(g) ΔH=-113.0 kJ·mol-1,2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1。SO2通常在NO2的存在下,进一步被氧化生成SO3(g)。写出NO2和SO2反应生成NO(g)和SO3(g)的热化学方程式为________。
2SO3(g) ΔH=-196.6 kJ·mol-1。SO2通常在NO2的存在下,进一步被氧化生成SO3(g)。写出NO2和SO2反应生成NO(g)和SO3(g)的热化学方程式为________。
(2)提高2SO2(g)+O2(g)![]() 2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
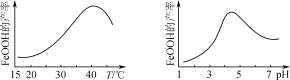
①温度为T℃时,在2 L的密闭容器中加入2.0 mol ![]() 和1.0 mol O2发生反应,达到平衡时容器内气体压强变为起始时的
和1.0 mol O2发生反应,达到平衡时容器内气体压强变为起始时的![]() 。该反应的平衡常数为_____。
。该反应的平衡常数为_____。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_____。
A.在其他条件不变时,减少容器的体积
B.在其他条件不变时,改用高效催化剂
C.在其他条件不变时,升高体系温度
D.1.0mol温度和容器体积不变,充入1.0 mol氦气![]()
E.温度和容器体积不变,充入1.0 mol O2
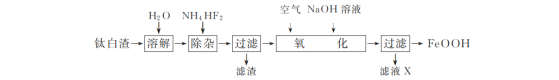
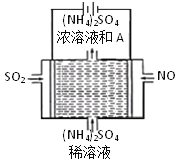
(3)利用如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为______;若通入的NO体积为4.48 L(标况下),则理论上另一电极通入SO2的物质的量应为_______。
【答案】NO2(g)+SO2(g)=NO(g)+SO2(g) ΔH=41.8 kJ/mol 1620 L·mol–1 AE NO + 6H+ + 5e=NH4+ +H2O 0.5 mol
【解析】
(1)![]() 和
和![]() 反应的化学方程式为2NO(g)+O2(g)
反应的化学方程式为2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1![]() ,2SO2(g)+O2(g)
,2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1.根据盖斯定律计算反应热;
2SO3(g) ΔH=-196.6 kJ·mol-1.根据盖斯定律计算反应热;
(2)①在相同体积及温度下,压强之比等于物质的量之比,结合三行式计算平衡时各物质的物质的量,代入平衡常数求算公式求解;
②依据勒夏特列原理分析各个条件下平衡移动的方向进而分析转化率的变化。
(3) 根据电解装置分析,通入NO的电极连接外电路负极,则该电极为电解池阴极, 电解池阴极发生还原反应,NO转化为 NH4+,H+参与电极反应,据此写出电极反应式,根据电子转移守恒计算。
(1)![]() 和
和![]() 反应的化学方程式为2NO(g)+O2(g)
反应的化学方程式为2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1![]() ,2SO2(g)+O2(g)
,2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1.根据盖斯定律(②-①)÷2计算反应NO2(g)+SO2(g)=NO(g)+SO2(g) ΔH=41.8 kJ/mol 故答案为NO2(g)+SO2(g)=NO(g)+SO2(g) ΔH=41.8 kJ/mol;
2SO3(g) ΔH=-196.6 kJ·mol-1.根据盖斯定律(②-①)÷2计算反应NO2(g)+SO2(g)=NO(g)+SO2(g) ΔH=41.8 kJ/mol 故答案为NO2(g)+SO2(g)=NO(g)+SO2(g) ΔH=41.8 kJ/mol;
(2)①则1L密闭容器在5min内各物质浓度发生的变化如下:
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始物质的量(mol) 2 1
变化物质的量(mol) 2x x 2x
平衡物质的量(mol) 2-2x 1-x 2x
由达到平衡时容器内气体压强变为起始时的![]() ,在一定温度和体积下压强之比等于物质的量之比可知
,在一定温度和体积下压强之比等于物质的量之比可知![]() =
=![]() ,故可知该反应达平衡时各物质的物质的量分别为:0.2mol,0.1 mol,1.8 mol,故该反应的平衡常数为1620 L·mol–1故答案为: 1620 L·mol–1;
,故可知该反应达平衡时各物质的物质的量分别为:0.2mol,0.1 mol,1.8 mol,故该反应的平衡常数为1620 L·mol–1故答案为: 1620 L·mol–1;
②A.在其他条件不变时,减少容器的体积,相当于增大压强,平衡正向移动,![]() 的转化率提高;
的转化率提高;
B.在其他条件不变时,改用高效催化剂,平衡不移动,转化率不变;
C.该反应为放热反应,升高体系温度,平衡向吸热方向即逆向移动,故 转化率降低;
D.温度和容器体积不变,充入1.0 mol氮气,平衡不移动,![]() 的转化率不变;
的转化率不变;
E.温度和容器体积不变,充入1.0molO2,平衡正向移动,![]() 的转化率提高;
的转化率提高;
故选AE。
(3)根据电解装置,NO和SO2转化为硫酸铵,说明NO转化成NH4+,即NO在阴极上发生 ![]() ,阳极反应式为
,阳极反应式为![]() ,根据得失电子数目守恒,因此有2NO~10e-~5SO2,求出SO2的物质的量为0.5mol, 故答案为
,根据得失电子数目守恒,因此有2NO~10e-~5SO2,求出SO2的物质的量为0.5mol, 故答案为 ![]() ,
,![]() ,0.5mol;
,0.5mol;

【题目】温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反应0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1时,反应的平衡常数K1=1.2
C. 其他条件不变,9 min后,向容器中再充入1.6 molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D. 其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0