题目内容
【题目】(1)下图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图。
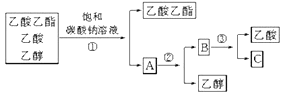
在实验③中需加入的试剂是_______,(填化学式),在上述实验过程中,所涉及的三次分离操作分别是(____)(填选项)
A.①蒸馏、②过滤、③分液 B.①分液、②蒸馏、③蒸馏
C.①蒸馏、②分液、③分液 D.①分液、②蒸馏、③结晶、过滤
(2)5.8g有机物完全燃烧,只生成CO2和H2O蒸汽,其体积比为1∶1(同压同温),若把它们通过碱石灰,碱石灰在增加18.6g,同量的有机物与0.1mol乙酸完全发生酯化反应。又知该有机物对空气的相对密度为2。
求:①有机物的相对分子质量___________;②有机物的结构简式_________________
【答案】 H2SO4 B 58 略
【解析】(1)乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水,且乙酸与碳酸钠反应得到醋酸钠,所以步骤①是互不相溶液体的分离,采用分液的方法;醋酸钠和乙醇的碳酸钠水溶液是互溶的,其中乙醇的沸点很低,可以采用蒸馏的方法将乙醇分离出来;对醋酸钠和碳酸钠,醋酸钠与硫酸反应得到醋酸,碳酸钠能和硫酸反应生成硫酸钠、水和二氧化碳,再蒸馏可以获得乙酸,所以在实验③中需加入的试剂是H2SO4,所涉及的三次分离操作分别是①分液、②蒸馏、③蒸馏,答案选B。(2)①该有机物对空气的相对密度为2,则有机物相对分子质量=29×2=58;②5.8g有机物的物质的量为5.8g÷58g/mol=0.1mol,燃烧生成CO2和H2O蒸汽,且体积比为1:1,碱石灰在增加18.6g为CO2和H2O的质量,则n(CO2)=n(H2O)=18.6g÷(44g/mol+18g/mol)=0.3mol,则有机物分子中N(C)=0.3mol÷0.1mol=3、N(H)=0.3mol×2/0.1mol=6、N(O)=(5812×36)/16=1,故有机物分子式为C3H6O;同量的有机物与0.1mol乙酸完全发生酯化反应,则有机物分子含有1个-OH,机物分子式为C3H6O,含有1个C=C双键,故其结构简式为CH2=CHCH2OH。

 名校课堂系列答案
名校课堂系列答案
