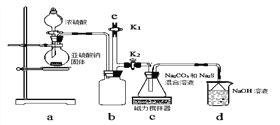
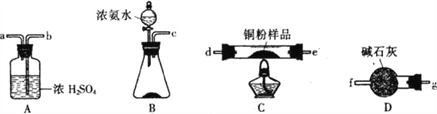
题目内容
【题目】【天津市红桥区下学期开学考试】向1L的密闭容器中加入1molX、3molZ和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
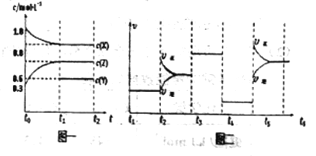
A. Y的起始物质的量为0.5mol
B. 该反应的化学方程式为:2X(g)+Y(g)![]() 3Z(g)ΔH<0
3Z(g)ΔH<0
C. 若t0=0,t1=10s,则t0-t1阶段的平均反应速率为v(z)=0.03mol/(L﹒s)
D. 反应物X的转化率t6点比t3点高
【答案】B
【解析】
t4-t5反应速率降低,但平衡不移动,说明t4时刻降低压强,即反应反应前后气体系数之和相等,x的浓度的变化(1-0.8)mol·L-1=0.2mol·L-1,Z的浓度的变化(0.6-0.3)mol·L-1=0.3mol·L-1,X和Z的系数之比为2:3,即Y的系数为1,Y的浓度变化为0.2/2mol·L-1=0.1mol·L-1,因此起始时Y的物质的量为(0.1+0.4)×1mol=0.5mol,故说法正确;B、根据选项A的分析,反应方程式2X(g)+Y(g) ![]() 3Z(g),根据图二,t5时刻应改变温度,正逆反应速率升高,因此t5是升高温度,反应向正反应方向进行,说明正反应是吸热反应,即△H>0,故说法错误;C、根据化学反应速率表达式,c(Z)=(0.6-0.3)/10mol/(L·s)=0.03 mol/(L·s),故说法正确;D、t5-t6时刻,平衡向正反应方向移动,X的转化率t6比t3高,故说法正确。化学平衡图像题是高考高频题,一般考查影响化学平衡移动的因素,同时要学会看图像,一般:一看面(纵、横坐标的意义),二看线(线的走向和变化趋势),三看点(起点、拐点、终点),四看辅助线(如等温线、等压线、平衡线),五看量的变化(如浓度的变化、温度变化),这些都需要夯实的基础知识,化学平衡的计算一般采用三段式解决(主要针对一个化学平衡),此题属于中档题。
3Z(g),根据图二,t5时刻应改变温度,正逆反应速率升高,因此t5是升高温度,反应向正反应方向进行,说明正反应是吸热反应,即△H>0,故说法错误;C、根据化学反应速率表达式,c(Z)=(0.6-0.3)/10mol/(L·s)=0.03 mol/(L·s),故说法正确;D、t5-t6时刻,平衡向正反应方向移动,X的转化率t6比t3高,故说法正确。化学平衡图像题是高考高频题,一般考查影响化学平衡移动的因素,同时要学会看图像,一般:一看面(纵、横坐标的意义),二看线(线的走向和变化趋势),三看点(起点、拐点、终点),四看辅助线(如等温线、等压线、平衡线),五看量的变化(如浓度的变化、温度变化),这些都需要夯实的基础知识,化学平衡的计算一般采用三段式解决(主要针对一个化学平衡),此题属于中档题。