题目内容
【题目】常温时,1 molL-1的HClO2和1molL-1的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液加水稀释至体积V,所得曲线如图所示,下列说法正确的是
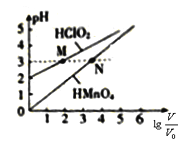
A. 酸性:HClO2>HMnO4
B. 稀释前分别用1molL-1的NaOH溶液中和,消耗的NaOH溶液体积: HMnO4 >HClO2
C. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
D. 在0≤pH≤5时,HMnO4溶液满足:pH=lg![]()
【答案】D
【解析】A.由图示可知1molL-1的HMnO4溶液pH为0,可知为HMnO4强酸,HClO2为弱酸,故A错误;B.两者都是一元酸且体积相同,则用NaOH溶液中和,消耗的NaOH溶液体积相等,故B错误;C.由溶液中的电荷守恒:c(H+)=c(ClO2-)+c(OH-),c(H+)=c(MnO4-)+c(OH-)当稀释至pH均为3时,溶液中c(ClO2-)=c(MnO4-),故C错误;D.HMnO4为强酸,在0≤pH≤5时,不需要考虑水的电离,c0(H+)V0= c(H+)V,c0(H+)=1molL-1,c(H+)=V0/V,两边取负对数即得pH=lg![]() ,故D正确;答案为D。
,故D正确;答案为D。

【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | ⑦ |
| |||||
三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
四 | ② | ④ | ⑨ |
(1) 11种元素中,化学性质最不活泼的是________。(填元素符号,下同)
(2) ①②⑤中,最高价氧化物对应的水化物碱性最强的是________。(填对应的碱)
(3) ②③④中形成的简单离子半径由大到小的顺序是________________________。(填离子)
(4) 元素⑦的氢化物分子式为________,该氢化物与元素⑧的单质反应的离子方程式是______ 。
(5) ①和⑨的最高价氧化物对应的水化物的化学式为__________和________。①和⑨两元素形成化合物的化学式为____,该化合物的水溶液与元素⑧的单质反应的离子方程式为__________。
(6) ①和⑤最高价氧化物对应的水化物相互反应的化学方程式为________________。
(7) ⑧⑨![]() 三种元素形成的气态氢化物最稳定的是______________________。
三种元素形成的气态氢化物最稳定的是______________________。