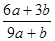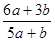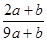题目内容
在4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O的反应中,被还原的硝酸与未被还原的硝酸的物质的量比为( )
| A.1∶9 | B.9∶1 | C.4∶2 | D.2∶4 |
A
试题分析:失去电子,化合价升高,被氧化。得到电子,化合价降低,被还原。根据方程式可知,氮元素的还原产物是NH4+,所以被还原的硝酸与未被还原的硝酸的物质的量比为1∶9,答案选A。
点评:该题是基础性试题的考查,也是高考中的常见考点,主要是考查学生对氧化还原反应有关概念以及应用的熟悉了解程度,旨在培养学生的逻辑思维能力,提高学生的应试能力。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案
相关题目