题目内容
将适量的XeO3投入30mL 0.1 mol/L Mn2+的水溶液中,刚好完全反应。此时转移电子_____________mol。将反应后的溶液稀释至90mL,所得溶液的pH=________。
0.015 (2分), 1 (2分)
试题分析:Mn2+是还原剂失去电子,被氧化生成MnO4—,所以反应中转移电子的物质的量是0.03L×0.1mol/L×(7-2)=0.015mol。根据方程式5XeO3 + 6Mn2+ +9H2O
 6MnO4— + 5Xe↑+ 18H+可知,生成氢离子的物质的量是0.009mol,则氢离子的浓度是0.009mol÷0.09L=0.1mol/L,则pH=1。
6MnO4— + 5Xe↑+ 18H+可知,生成氢离子的物质的量是0.009mol,则氢离子的浓度是0.009mol÷0.09L=0.1mol/L,则pH=1。点评:该题是常识性计算题的考查,难度不大。该题的关键是明确反应的原理,准确标出有关元素的化合物变化,然后直接列式计算即可。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Cu2S+3SO2+ 2FeO(炉渣);②2Cu2S+3O2
Cu2S+3SO2+ 2FeO(炉渣);②2Cu2S+3O2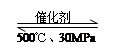 2NH3(g)△H=-38.6kJ·mol-1
2NH3(g)△H=-38.6kJ·mol-1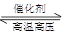 2NH3(g)△H﹤0,升高温度,可使反应速率增大,反应逆向移动
2NH3(g)△H﹤0,升高温度,可使反应速率增大,反应逆向移动