题目内容
(每格2分,共8分)配平该化学方程式
□K37ClO3 + □H35Cl —□KCl+□Cl2 +□H2O.
该反应中HCl体现了_______性,若反应中有1.5mol电子发生转移生成Cl2________mol,所得Cl2的相对分子质量是_________(保留小数点后一位) 。
□K37ClO3 + □H35Cl —□KCl+□Cl2 +□H2O.
该反应中HCl体现了_______性,若反应中有1.5mol电子发生转移生成Cl2________mol,所得Cl2的相对分子质量是_________(保留小数点后一位) 。
(8分)1K37ClO3 + 6H35Cl=1KCl+3Cl2 +3H2O
酸性,还原性 0.9 70.7(每格2分)
酸性,还原性 0.9 70.7(每格2分)
试题分析:根据化合价升降可以配平方程式:1K37ClO3 + 6H35Cl=1KCl+3Cl2 +3H2O,因为H35Cl中有1个35Cl化合价没有变化,生成物是氯化钾,说明起酸的作用,5个35Cl变为Cl2,说明起还原剂的作用;该反应中生成3个氯气分子,转移5个电子,则转移1.5mol电子,生成氯气是0.9mol;3个氯气分子中含有5个35Cl,1个37Cl,则Cl2的相对分子质量是
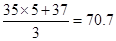 。
。点评:通过化合价升降配平方程式然后根据方程式考查概念及计算,属于中档题。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2Fe + 3CO2
2Fe + 3CO2