题目内容
3.现有两瓶溶液,新制饱和氯水和亚硫酸,下列方法或试剂(必要时可加热)能用于鉴别它们的是:①观察颜色;②石蕊试剂;③品红溶液( )| A. | ①②③ | B. | 只有①③ | C. | 只有②③ | D. | 只有① |
分析 根据氯水的成分和性质以及亚硫酸的性质的差异进行鉴别,氯水含多种微粒,其中有H2O、Cl2、HClO、Cl-、H+、OH-(极少量,水微弱电离出来的),次氯酸的漂白性具有永久性,二氧化硫漂白性具有暂时性.
解答 解:①Cl2是新制氯水的主要成分,溶液呈浅黄绿色,而亚硫酸无色,故①正确;
②氯水中含有HCl和HClO,能使石蕊试液先变红后褪色,而亚硫酸只能使石蕊试液变红,故②正确;
③HClO的强氧化性将有色物质氧化成无色物质,不可逆,SO2能使品红溶液褪色,加热会恢复原来的颜色,故③正确;
故选A.
点评 本题考查物质的鉴别,为高频考点,明确物质性质的差异性是解本题关键,注意:二氧化硫和次氯酸漂白性差别,二氧化硫能漂白品红溶液但不能漂白酸碱指示剂,为易错点.

练习册系列答案
相关题目
13.Na2S溶液中存在多种微粒,下列各微粒间的关系正确的是( )
| A. | c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | B. | c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | ||
| C. | c(Na+)=c(HS-)+2c(H2S)+2c(S2-) | D. | c(OH-)=c(H+)+c(HS-)+2c(H2S) |
14.现有KCl和KBr的混合物3.87g,将混合物全部溶于水,并加入过量的AgNO3溶液,充分反应后产生6.63g沉淀物,则原混合物中钾元素的质量分数为( )
| A. | 24.1% | B. | 25.9% | C. | 40.3% | D. | 48.1% |
11.E和F加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)?G(g),已知该反应的平衡常数值如下表所示.下列说法正确的是( )
| 温度℃ | 25 | 80 | 230 |
| 平衡常数值 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述反应是熵增反应 | |
| B. | 25℃时,反应G(g)?E(s)+4F(g)的平衡常数值是0.5 | |
| C. | 在80℃时,测得某时刻,F、G浓度均为0.5 mol•L-1,则此时v(正)<v(逆) | |
| D. | 恒温恒容下,向容器中再充入少量G(g),达新平衡时,F的体积百分含量将增大 |
15.已知某强氧化剂RO(OH)2+ 中的R元素被Na2SO3还原到低价态.如果还原2.4×10-3mol RO(OH)2+ 至较低价态,需要60 mL 0.1 mol/L的Na2SO3溶液.那么,R元素被还原成的价态是( )
| A. | -1 | B. | 0 | C. | +1 | D. | +2 |
12.下列分子中所有原子一定处于同一平面的是( )
| A. | CH3CH2CH=CH2 | B. | CH4 | C. | C6H5-C≡CH | D. | CH3CH=CH2 |
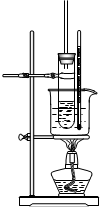 (1)试回答下列中学化学实验中常见仪器的有关问题:在仪器①分液漏斗、②试剂瓶、③集气瓶、④滴瓶、⑤滴定管、⑥容量瓶、⑦量筒、⑧托盘天平中,标有“0”刻度的是(填序号,下同)⑤⑧;标有使用温度的仪器是⑤⑥⑦.用到“磨砂”处理的有①②③④⑤⑥.
(1)试回答下列中学化学实验中常见仪器的有关问题:在仪器①分液漏斗、②试剂瓶、③集气瓶、④滴瓶、⑤滴定管、⑥容量瓶、⑦量筒、⑧托盘天平中,标有“0”刻度的是(填序号,下同)⑤⑧;标有使用温度的仪器是⑤⑥⑦.用到“磨砂”处理的有①②③④⑤⑥.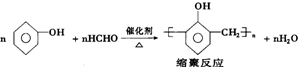 .
.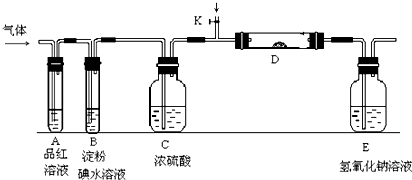
 ,Y2W2的结构式为Cl-S-S-Cl.
,Y2W2的结构式为Cl-S-S-Cl.