题目内容
1.以下实验方法肯定错误的是( )| A. | 判断H2O2分解速率的大小,可以通过测定单位时间内H2O2分解放出的O2的体积 | |
| B. | 制摩尔盐时用酒精洗涤产品 | |
| C. | 用米汤直接检验食用盐中是否含有碘元素 | |
| D. | 以硝酸钠和氯化钾为原料可以制备硝酸钾 |
分析 A.单位时间内H2O2分解放出的O2的体积可判断H2O2分解速率的大小;
B.摩尔盐在有机溶剂中的溶解度小;
C.食盐中的碘以碘酸钾的形式存在;
D.氯化钠溶解度随着温度的升高变化不大,而硝酸钾溶解度受温度的影响程度很大,降温结晶时先析出的是硝酸钾晶体.
解答 解:A.通过测定单位时间内H2O2分解放出的O2的体积可判断H2O2分解速率的大小,故A正确;
B.摩尔盐在有机溶剂中的溶解度小,因此制摩尔盐时用酒精洗涤产品,可以减少晶体的溶解,故B正确;
C.食盐中的碘以碘酸钾的形式存在,只有单质碘才能与淀粉发生显色反应,故C错误;
D.氯化钠溶解度随着温度的升高变化不大,而硝酸钾溶解度受温度的影响程度很大,降温结晶时先析出的是硝酸钾晶体,正确的操作是:取原料→配成热饱和溶液→降温结晶→趁热过滤→提纯,可制备硝酸钾,故D正确.
故选C.
点评 本题考查化学实验方案的评价,涉及有机物的制备、鉴别、分离和提纯等操作,题目难度不大,注意物质的性质.

练习册系列答案
相关题目
11.能够证明乙醇分子(C2H6O) 组成的最充分的理由是( )
| A. | 23g乙醇与足量的金属钠反应,可以放出0.25mol 氢气 | |
| B. | 1mol 乙醇充分燃烧生成2mol CO2 和3mol H2O,消耗3mol O2 | |
| C. | 乙醇的沸点高于乙烷 | |
| D. | 1mol 乙醇氧化后生成1mol 乙醛 |
12.下列离子在酸性溶液中能大量共存的是( )
| A. | Fe3+、NH4+、SCN-、Cl- | B. | Na+、K+、NO3-、SO42- | ||
| C. | Fe2+、K+、Na+、NO3- | D. | Fe2+、NH4+、Cl-、OH- |
16.下列有关晶体的叙述中不正确的是( )
| A. | 在晶体中只要有阴离子就一定有阳离子 | |
| B. | 1mol SiO2晶体中含2mol Si-O键 | |
| C. | 干冰晶体中每个CO2分子周围紧邻12个CO2分子 | |
| D. | 金刚石晶体中的最小环由6个碳原子构成 |
6.下列混合溶液中,各离子浓度的大小顺序不正确的是( )
| A. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| B. | 物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合:离子浓度的大小顺序是:c (Na+)>c (HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | CH3COONa溶液中c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
13.Na2S溶液中存在多种微粒,下列各微粒间的关系正确的是( )
| A. | c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | B. | c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | ||
| C. | c(Na+)=c(HS-)+2c(H2S)+2c(S2-) | D. | c(OH-)=c(H+)+c(HS-)+2c(H2S) |
10.下列物质的提纯或离子检验的方法正确的是( )
| A. | 用渗析的方法精制氢氧化铁胶体 | |
| B. | 以精铜为阳极,粗铜为阴极,CuSO4溶液为电解液精炼铜 | |
| C. | 除去KCl溶液中的少量MgCl2,加入过量KOH溶液,然后过滤即可 | |
| D. | 加入澄清石灰水,能产生白色沉淀,则原溶液中一定含有CO32- |
11.E和F加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)?G(g),已知该反应的平衡常数值如下表所示.下列说法正确的是( )
| 温度℃ | 25 | 80 | 230 |
| 平衡常数值 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述反应是熵增反应 | |
| B. | 25℃时,反应G(g)?E(s)+4F(g)的平衡常数值是0.5 | |
| C. | 在80℃时,测得某时刻,F、G浓度均为0.5 mol•L-1,则此时v(正)<v(逆) | |
| D. | 恒温恒容下,向容器中再充入少量G(g),达新平衡时,F的体积百分含量将增大 |
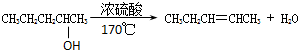 消去反应
消去反应 取代反应
取代反应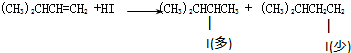 加成反应
加成反应 取代反应
取代反应