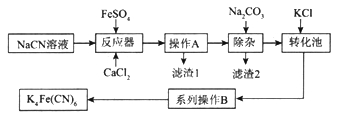
题目内容
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用N2H4作为火箭发射的助燃剂。N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4·H2O。用电离方程式表示N2H4·H2O显碱性的原因是:________。
(2)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H=+210.5kJ· mol-1
②CaSO4(s)+4CO(g) CaS(s)+ 4CO2(g) △H=-189.2 kJ· mol-1
反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) △H=____kJ· mol-1
(3)在恒温条件下,1 mol NO2和足量C发生反应2NO2(g)+2C(s)![]() N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
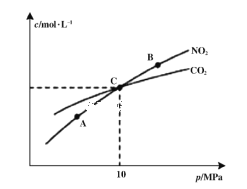
①A、B两点的浓度平衡常数关系:Kc(A) ____Kc(B)(填“<”或“>”或“=”)
②A、B、C三点中NO2的转化率最高的是____(填“A”或“B”或“C”)点。
(4)已知:亚硝酸(HNO2)性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.2×10-7,Ka2=5.61×10-11。在常温下向含有2mol碳酸钠的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小的顺序是________。
【答案】N2H4·H2ON2H5++OH-(或N2H4+H2ON2H5++OH-) -399.7 = A c(HCO3-)>c(NO2-)>c(CO32-)
【解析】
N2H4·H2O显碱性说明其电离出氢氧根离子,并根据弱碱不完全电离书写其电离方程式。根据盖斯定律分析反应热。根据平衡常数只与温度有关进行分析。根据平衡时浓度越小,说明其转化率越高进行分析。根据碳酸钠和亚硝酸反应生成亚硝酸钠和碳酸氢钠分析反应生成等物质的量的三种物质,根据电离平衡常数分析,碳酸根离子水解程度最大,则溶液中碳酸氢根离子浓度最大,碳酸根离子浓度最小进行排序。
(1) N2H4·H2O显碱性说明其电离出氢氧根离子,且其为弱碱,所以电离方程式为:N2H4·H2ON2H5++OH-(或N2H4+H2ON2H5++OH-);
(2) ①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H=+210.5kJ· mol-1
②CaSO4(s)+4CO(g) CaS(s)+ 4CO2(g) △H=-189.2 kJ· mol-1
根据盖斯定律分析,②-①得反应:CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) △H=-189.2-210.5=-399.7kJ· mol-1;
(3) ①平衡常数只与温度有关,在恒温条件下平衡常数相等;
② 平衡时二氧化氮的浓度越小,说明其转化率越大,故A点转化率最高;
(4)碳酸钠和亚硝酸反应的方程式为:Na2CO3+HNO2=NaHCO3+NaNO2,含有2mol碳酸钠的溶液中加入1mol的HNO2反应后生成1mol碳酸氢钠和1mol亚硝酸钠 ,还有剩余的1mol碳酸钠,根据电离平衡常数分析,碳酸根离子水解程度最大,所以三种离子中碳酸氢根离子浓度最大,碳酸根离子浓度最小,即离子浓度关系为c(HCO3-)>c(NO2-)>c(CO32-)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度(绝对温度) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)推导反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_____________________。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_____________________。
(2)通过K值的计算,(1)中的反应是_________反应(填“吸热”或“放热”)。
(3)在一体积为10L的密闭容器中,加入一定量的CO2和H2O(g),在1173开时发生反应并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
时间/min | CO2 | H2O | CO | H2 |
0 | 0.2000 | 0.3000 | 0 | 0 |
2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | |
5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
6 | 0.0350 | 0.1350 | 0.1650 |
①前2min,用CO表示的该化学反应的速率是:_______________________。
②在3~4min之间,反应处于___________状态(填“平衡”或“非平衡”)。
③第6min时,平衡向_________方向移动,可能的原因是______________________。
【题目】铝鞣剂在皮革工业有广泛应用。某学习小组以铝灰为原料制备铝鞣剂[ Al(OH)2Cl],设计如下化工流程(提示:铝灰的主要成分是Al、Al2O3、AlN、FeO等):
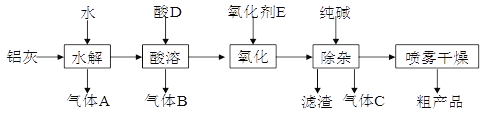
请回答下列问题:
(1)酸D的化学式为__________;气体C的电子式___________。
(2)实验室检验气体A的操作是________________;“水解”温度保持在90℃左右,写出水解生成A的化学方程式:________________________。
(3)“酸溶”温度控制在30℃~35℃,不宜太低,也不宜太高,其原因是_________________;氧化剂E宜选择_________(填字母)。
A.漂白液 | B.稀硝酸 | C.酸性高锰酸钾溶液 | D.溴水 |
(4)“除杂”过程中产生滤渣的离子方程式为_________________________。
(5)粗产品略显浅黄色,可能含有的杂质主要是_________________(填化学式)。
若用“蒸发”代替“喷雾干燥”,其后果是____________________________。
【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)①铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是___ (填字母)。
A. 电子从基态跃迁到较高的激发态 B. 电子从较高的激发态跃迁到基态
C. 焰色反应的光谱属于吸收光谱 D. 焰色反应的光谱属于发射光谱
②碘、铜两种元素的电负性如表:
元素 | I | Cu |
电负性 | 2.5 | 1.9 |
CuI属于_______(填“共价”或“离子”)化合物。
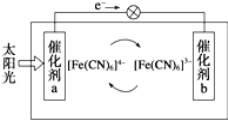
(2)氯化铁溶液用于检验食用香精乙酰乙酯时,会生成紫色配合物,其配离子结构如图所示。
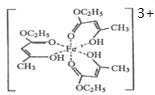
①此配合物中,基态铁离子的价电子排布图为________________。
②此配合物中碳原子的杂化轨道类型有________________。
③此配离子中含有的化学键有____________(填字母)。
A.σ键 B.π键 C.极性键 D.非极性键 E. 配位键 F. 氢键 G.离子键
(3)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是_____________。
(4)治疗铅中毒可滴注依地酸(别名EDTA,结构如下面左图)钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_________(填标号)
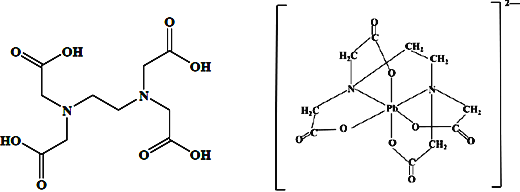
A.形成依地酸铅离子所需n(Pb2+):n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
(5)AlCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态还是气态,一个分子中的氯原子与另外一个铝原子形成配位键,因此以二聚体Al2Cl6的形式存在,写出Al2Cl6的结构式_______(用→标出配位键)。