题目内容
【题目】近段时间,全国范围内的雾霾天气严重影响了人们的身体健康,环境问题越来越受到人们的重视。汽车尾气中含有较多的NO和CO,两种气体均会使人体中毒。处理大气中的污染物,打响“蓝天白云”保卫战是当前的重要课题
请回答下列问题
(1)一氧化碳、氢气既是重要的能源,也可以催化还原NO等消除污染,还可以在一定条件下制取CH3OH。
已知:①N2(g)+O2(g)===2NO(g) △H=+180.5kJ·mol-1;
②2H2(g)+ O 2(g)===2H2O(1) △H=-571.6kJ·mol-1;
③H2O(g)===H2O(1) △H=-44kJ·mol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:______________________。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。在密闭容器中充有10 mol CO和20molH2,在催化剂作用下发生反应生成甲醇,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。则该反应的△H___________0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时平衡常数K=___________,此时容器的体积为___________L。
CH3OH(g)。在密闭容器中充有10 mol CO和20molH2,在催化剂作用下发生反应生成甲醇,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。则该反应的△H___________0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时平衡常数K=___________,此时容器的体积为___________L。

(3)工业上采用加压条件下,在含冷却装置的吸收塔中,以去离子水为吸收剂吸收NO,得到40%的硝酸。原理如下:
2NO(g)+O2(g)![]() 2NO2(g) △H=-114 kJ/mol
2NO2(g) △H=-114 kJ/mol
3NO2(g)+H2O(l)![]() 2 HNO3(aq)+ NO(g) △H=-69 92 kJ/molo
2 HNO3(aq)+ NO(g) △H=-69 92 kJ/molo
采用降温操作的两个原因是_________________________________。
(4)利用电解原理也可以处理工厂烟气。如图为工业生产模拟装置。其中A、B为多孔电极(外接电源未画出),则A为___________极(填“正”“负”“阴”或“阳”),电极反应式为______________________。Ⅹ溶液中溶质的成分为___________(填化学式)。

【答案】2H2(g)+2NO(g)=2H2O(g)+N2(g) △H=-664.1 kJ![]() mol-1 < 1 2 降低温度平衡正向移动,硝酸高温下易分解 阳极
mol-1 < 1 2 降低温度平衡正向移动,硝酸高温下易分解 阳极 ![]()
![]()
【解析】
(1)根据盖斯定律书写H2与NO反应生成N2和水蒸气的热化学方程式;(2)根据图像,随温度升高,CO的转化率降低,说明平衡逆向移动;利用“三段式”计算![]() 时的平衡常数;根据温度相同时,平衡常数相等计算B点的体积;(3)以去离子水为吸收剂吸收NO得到40%的硝酸的反应放热,硝酸高温下易分解;(4) A极SO2失电子发生氧化反应生成SO42-,B极NO得电子发生还原反应生成NH4+;根据电解池总反应判断X溶液中的溶质。
时的平衡常数;根据温度相同时,平衡常数相等计算B点的体积;(3)以去离子水为吸收剂吸收NO得到40%的硝酸的反应放热,硝酸高温下易分解;(4) A极SO2失电子发生氧化反应生成SO42-,B极NO得电子发生还原反应生成NH4+;根据电解池总反应判断X溶液中的溶质。
(1)已知①N2(g)+O2(g)=2NO((g)△H=+180.5 kJ![]() mol-1
mol-1
②2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ![]() mol-1
mol-1
③H2O(g)=H2O(1)△H=-44 kJ![]() mol-1,
mol-1,
则利用盖斯定律将②-③![]() -①可得2H2(g)+2NO(g)=2H2O(g)+N2(g) △H=-571.6kJ
-①可得2H2(g)+2NO(g)=2H2O(g)+N2(g) △H=-571.6kJ![]() mol-1-(-44 kJ
mol-1-(-44 kJ![]() mol-1)×2-180.5 kJ
mol-1)×2-180.5 kJ![]() mol-1=-664.1 kJ
mol-1=-664.1 kJ![]() mol-1;
mol-1;
(2)(2)根据图像,随温度升高,CO的转化率降低,说明平衡逆向移动,所以△H<0;
当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol/L):1 2 0
转化(mol/L):0.5 1 0.5
平衡(mol/L):0.5 1 0.5
k=![]() 1,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
1,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol):10 200
转化(mol):816 8
平衡(mol):2 4 8
设体积为VL,则有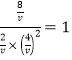 ,解得V=2;
,解得V=2;
(3)以去离子水为吸收剂吸收NO得到40%的硝酸的反应放热,降低温度平衡正向移动,硝酸高温下易分解,所以采用降温操作;
(4)根据图示,A极SO2失电子发生氧化反应生成SO42-,则A为阳极,电极反应式是![]() 。根据总反应
。根据总反应![]() ,X溶液中的溶质是
,X溶液中的溶质是![]() 。
。

【题目】四氯化锡可用作媒染剂。利用如图装置可以制备四氯化锡(部分夹持装置已略去)。

有关信息如下表:
化学式 |
|
|
摩尔质量( | 190 | 261 |
熔点 | 246 | -33 |
沸点 | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)装置甲中仪器![]() 的名称为_____________。
的名称为_____________。
(2)用装置甲制取氯气,![]() 被还原为
被还原为![]() ,该反应的离子方程式为___________。
,该反应的离子方程式为___________。
(3)将如图装置连接好,先检查装置气密性,再慢慢滴入浓盐酸,待观察到___________(填现象)后,开始加热装置丁,锡熔化后适当增大氯气流量,继续加热装置丁,此时继续加热装置丁的目的是:①促进氯气与锡反应;②_________________________。
(4)如果缺少装置乙,可能发生的副反应的化学方程式为_______________;装置己的作用是______(填字母代号)。
A.除去未反应的氯气,防止污染空气
B.防止空气中![]() 气体进入装置戊
气体进入装置戊
C.防止水蒸气进入装置戊的试管中使产物水解
D.防止空气中![]() 进入装置戊的试管中使产物氧化
进入装置戊的试管中使产物氧化
(5)某同学认为丁装置中的反应可能产生![]() 杂质,以下试剂中可用于检测是否产生
杂质,以下试剂中可用于检测是否产生![]() 的是______(填字母代号)。
的是______(填字母代号)。
A. ![]() 溶液 B.
溶液 B. ![]() 溶液(滴有
溶液(滴有![]() 溶液) C.
溶液) C. ![]() 溶液
溶液
(6)反应中用去锡粒![]() ,反应后在戊装置的试管中收集到
,反应后在戊装置的试管中收集到![]() ,则
,则![]() 的产率为_____(保留3位有效数字)。
的产率为_____(保留3位有效数字)。
【题目】下列操作、现象和结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 将等体积等浓度的HX和HY与足量的锌反应,收集产生的氢气并记录其体积 | HX收集到的氢气多 | HX是强酸 |
B | 向滴有酚酞的碳酸钠溶液中加入少量的氯化钡固体 | 红色变浅 | 碳酸钠溶液中存在水解平衡 |
C | 向反应FeCl3+3KSCN | 红色变浅 | 增大KCl的浓度,平衡逆向移动 |
D | 常温下分别测量等浓度的K2SO3和KCl溶液的pH | pH:K2SO3>KCl | 非金属性:Cl>S |
A. AB. BC. CD. D