题目内容
18.0.1mol Na、Na2O、Na2O2、NaOH,分别投入100g的水中,溶液的质量分数分别为3.91%、7.53%、7.53%、3.85%.分析 根据2Na+2H2O=2NaOH+H2↑,计算生成氢氧化钠、氢气质量,溶液质量=m(Na)+m(水)-m(氢气);
根据Na2O+H2O=2NaOH,计算生成氢氧化钠质量,溶液质量=m(Na2O)+m(水);
根据2Na2O2+2H2O=4NaOH+O2↑,计算生成氢氧化钠、氧气质量,溶液质量=m(Na2O2)+m(水)-m(氧气);
NaOH溶于水,溶液质量=m(NaOH)+m(水),溶液中溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%.
解答 解:设钠反应生成氢氧化钠质量为m、生成氢气质量为n,则:
2Na+2H2O=2NaOH+H2↑
2mol 80g 2g
0.1mol m n
m=$\frac{0.1mol×80g}{2mol}$=4g,n=$\frac{0.1mol×2g}{2mol}$=0.1g
溶液质量=0.1mol×23g/mol+100g-0.1g=102.2g,故NaOH质量分数为$\frac{4g}{102.2g}$×100%=3.91%;
设氧化钠反应生成NaOH质量为a,则:
Na2O+H2O=2NaOH
1mol 80g
0.1mol a
a=$\frac{0.1mol×80g}{1mol}$=8g
溶液质量=0.1mol×62g/mol+100g-0.1g=106.2g,故NaOH质量分数为$\frac{8g}{106.2g}$×100%=7.53%;
设过氧化钠反应生成氢氧化钠质量为x、生成氢气质量为y,则:
2Na2O2+2H2O=4NaOH+O2↑
2mol 160g 32g
0.1mol x y
x=$\frac{0.1mol×160g}{2mol}$=8g,y=$\frac{0.1mol×32g}{2mol}$=1.6g
溶液质量=0.1mol×78g/mol+100g-1.6g=106.2g,故NaOH质量分数为$\frac{8g}{106.2g}$×100%=7.53%;
NaOH溶于水,溶液质量=0.1mol×40g/mol+100g=104g,故NaOH质量分数为$\frac{0.1mol×40g/mol}{104g}$×100%=3.85%,
故答案为:3.91%;7.53%;7.53%;3.85%.
点评 本题考查化学方程式计算、质量分数计算,难度不大,关键是计算溶液的质量.

| A. | 3.8g | B. | 4.8g | C. | 5.6g | D. | 6.0g |
 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )| A. | ROH是一种强碱 | B. | 在x点,MOH并没有完全电离 | ||
| C. | 在x点,c(M+)=c(R+) | D. | 稀释前,c(ROH)=10c(MOH) |
| 物质 | 试剂 | 分离方法 | |
| A | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶、过滤 |
| B | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| C | 苯(硝基苯) | / | 蒸馏 |
| D | 苯(苯酚) | 浓溴水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 蒸馏水和0.1 mol•L-1NaOH溶液中的c(H+),前者大于后者 | |
| B. | 红棕色的NO2加压后颜色先变深后变浅 | |
| C. | 高温及加入催化剂都能使合成氨的反应速率加快 | |
| D. | 用加热蒸干AlCl3溶液的办法不能制得无水AlCl3 |
| A. | 用氢氧化钠溶液鉴别MgCl2溶液和AlCl3溶液 | |
| B. | 利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| C. | 用品红试液鉴别SO2和CO2两种气体 | |
| D. | 用焰色反应鉴别NaCl、KCl和Na2SO4 |
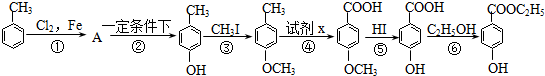
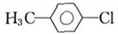 .
.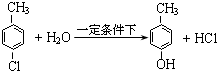 .
.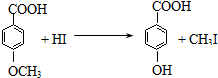 .
.