题目内容
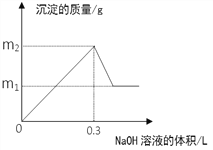
【题目】已知0.1mol/L的碳酸氢钠溶液的pH为8.4,则下列说法正确的是()
A. 加入少量NaOH固体,钠离子和碳酸根离子浓度均增大
B. 将该溶液加水稀释,![]() 的比值保持不变
的比值保持不变
C. c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
D. c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3)
【答案】A
【解析】A、加入氢氧化钠发生NaOH+NaHCO3=Na2CO3+H2O,Na+物质的量浓度增大,CO32-的物质的量浓度增大,故A正确;B、加水稀释,促进HCO3-的水解,HCO3-的物质的量减小,Na+物质的量不变,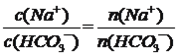 ,因此此比值增大,故B错误;C、根据溶液电中性,c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO3)2-,故C错误;D、根据物料守恒,因此由c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故D错误。
,因此此比值增大,故B错误;C、根据溶液电中性,c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO3)2-,故C错误;D、根据物料守恒,因此由c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故D错误。

 名校课堂系列答案
名校课堂系列答案【题目】某化学兴趣小组对Fe3O4产生了兴趣,从参考资料中找到了氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图:
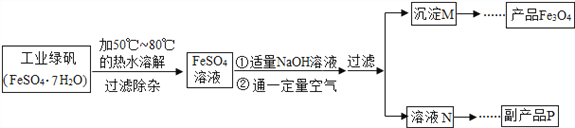 【查阅资料】
【查阅资料】
资料一:硫酸亚铁在不同温度下的溶解度如表所示:
温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
资料二:Fe(OH)2受氧气氧化反应原理为:4Fe(OH)2 +2H2O+O2=4Fe(OH)3
资料三:获得Fe3O4的反应原理为:Fe(OH)2 + 2Fe(OH)3 ![]() Fe3O4+4H2O
Fe3O4+4H2O
Ⅰ【问题讨论】
(1)溶解时,用50℃至80℃的热水目的是__________________________________________。
(2)副产品P是___________________________。
(3)为了得到纯净的产品,过滤、洗涤后进行的具体操作过程为______________________________、干燥
Ⅱ【组成确定】
资料显示:①铁的氢氧化物在受热时分解生成铁的氧化物(化合物不变);
②Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe。
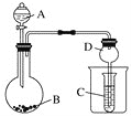
为确定用以上方法制得的四氧化三铁的纯度,同学们称取了23.28g该Fe3O4样品设计下列实验进行探究。
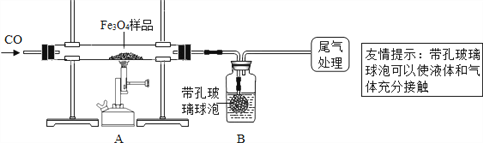
(1)该组同学欲通过称量B装置反应前后的质量变化来计算确认该Fe3O4样品中的杂质。B中的最佳试剂是_______________________(填序号)。
A.澄清石灰水 B.氢氧化钠浓溶液 C.稀盐酸 D.水
(2)上述实验过程中,CO气体除作为反应物外,能起到的作用还有:
①实验开始时,排尽装置中的空气,防止加热时发生爆炸;
②停止加热后,继续通CO气体,防止生成物被氧化,以及B中的溶液倒吸入A中;且可以_____________________________,以提高实验的精确度。
(3)利用仪器测定并绘制出反应过程中
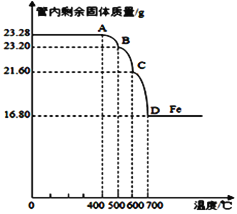
①该Fe3O4样品中含有的杂质成分______________________(填化学式)
②计算样品中Fe3O4的质量分数(写出必要的计算过程)。 _____________