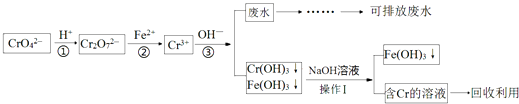
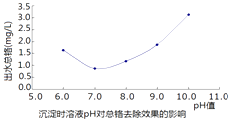
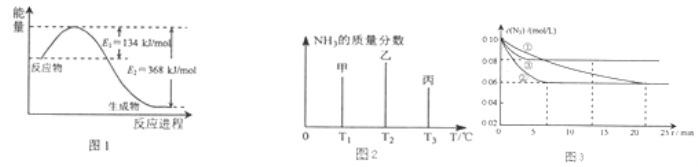
��Ŀ����
����Ŀ����m1gͭ���Ͻ�Ͷ�뵽1 L��H2SO4��HNO3�Ļ����Һ�����Ͻ���ȫ�ܽ��ֻ����VL ����������������״��������Ӧ�����Һ����μ���1mol/L NaOH��Һ�����ɳ���������������NaOH��Һ������Ĺ�ϵ����ͼ��ʾ������˵���в���ȷ������
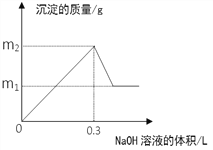
A. 2c(H2SO4) + c(HNO3) = 0.8 mol��L-1
B. m2��m1=5.1
C. ԭ�Ͻ���������������Ϊ34.7%
D. V = 2.24
���𰸡�A
����������ͭ���������ʵ����ֱ�Ϊx��y������ͭ��������������������ͭ�������У�64x+27y=98x���ռ����������Ƽ�����������˵����Һ��û��H+ʣ�࣬����ͭ���ӡ����������ĵ�����������֮��Ĺ�ϵ��2x+3y=0.3�����x=2.7/52mol��y=1.7/26mol�����������������Ļ���ᷴӦʱ�ļ���Ӧ�����ӷ���ʽ���㣬����3Cu+8H ++2NO3-=3Cu2++2NO��+4H2O��֪Cu���ĵ������ӵ����ʵ���Ϊ8x/3������Al+4H ++NO3-=Al3++NO��+2H2O��֪Al���ĵ������ӵ����ʵ���Ϊ4y������ԭ�����Һ�����������ӵ����ʵ���Ϊ4y+8x/3=0.4mol������ԭ������������ӵ��ܵ����ʵ���Ũ��Ϊ0.4mol/L����2c(H2SO4) + c(HNO3) = 0.4mol��L-1��A����Cu(OH)2��Al(OH)3���ֳ������������ڽ�������������Mg2+��Al3+����ϵ�OH-����������ϵ�OH-�����ʵ���Ϊ0.3mol������m2=m1+0.3��17g=m1+5.1g������m2��m1=5.1��B��ȷ����Ϊ��Ͻ���Cu��Al����������Cu(OH)2������������ԭ�Ͻ�������������������Cu(OH)2��OH-����������Ϊ34��98��100%=34.7%��C��ȷ�����ݵ�ʧ�����غ��֪����Ͻ���ʧȥ�ĵ��ӵ����ʵ���Ϊ2x+3y=0.3mol��HNO3�е�NԪ�ش�+5�۽��͵�+2�ۣ��������ɵ�NO�����ʵ���Ϊ0.3/3=0.1mol���ʱ�״���������Ϊ2.24L��D ��ȷ������ȷ�Ĵ�ΪA��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�