��Ŀ����
����Ŀ��Na2O2����ѧ��ѧ���õ�ǿ����������������CO2��H2O��Ӧ�⣬������������ԭ����H2��C������Ӧ��ij��ѧ������ȤС��Ϊ̽��Na2O2��H2�ķ�Ӧ��������������ͼ��ʾװ�ý����й�ʵ�顣

��1����װ���У������������շ�����֮���װ�õ������ԣ�_________________________________��
��2������ɸ�ʵ����йز������衣
�ټ��װ�������ԣ�
�ڴ�a��b�����������۲��Թ������ʵ���ɫ�仯��
��____________________________________________________��
�ܼ��ȹ������ƣ��۲��Թ������ʵ���ɫ�仯��
�ݷ�Ӧ��ȫ��__________________________________________��
��жװ�á�
��3����װ���У���ʯ�ҵ�������_________________________ ��
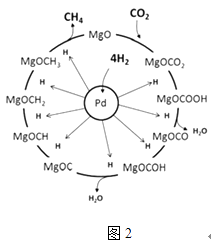
��4��ʵ������й۲쵽(2)�в���������Ա仯�������Na2O2�ۻ���ɫ��ĩ������ɰ�ɫ�������������ͭδ�����ɫ����Na2O2��H2��Ӧ�Ļ�ѧ����ʽΪ_________��
���𰸡� �ر�a����b������һ���ܲ�����ˮ���У����������Թ�(�����Լ����Թ�)�����۲쵽���ܿ�������ð������ȴ�Թܺ������γ�һ���ȶ���ˮ������˵��װ������������ �ڸ�����ϵ���һ֧С�Թ��ռ�H2������H2�Ĵ��� �ȳ���ƾ��ƣ����Թ���ȴ��ر�b ��ȥH2�е�HCl��ˮ���� Na2O2��H2![]() 2NaOH
2NaOH
���������������������ͨ��̽��Na2O2��H2�ķ�Ӧ������װ�������Եļ�飬����ʵ�鲽�裬ʵ������ķ�������ѧ����ʽ����д��
��1���������շ�����֮���װ�õ������Կ����ȷ����������Ϊ���ر�a����b������һ���ܲ�����ˮ���У����������Թ��������Լ����Թ��������۲쵽���ܿ�������ð������ȴ�Թܺ������γ�һ���ȶ���ˮ������˵��װ��������������
��2������������̽��H2��Na2O2�������ܷ�Ӧ��ͬʱ�ɽ�װ���п����ų������������ȹ������ƣ�����̽��H2��Na2O2����ʱ�ķ�Ӧ������Ҫ���ȣ���H2����ʱ�ᷢ����ը�����Լ��ȹ�������֮ǰҪ����H2�Ĵ��ȣ�������Ϊ�ڸ�����ϵ���һ֧С�Թ��ռ�H2������H2�Ĵ��ȡ�ʵ�����ʱ��Ϊ�˷�ֹ�������Ӹ���ܽ����Թ���ʹH2����������ը��������Ӧ�ȳ���ƾ��ƣ����Թ���ȴ��ر�b�������Թ���ȴ��ֹͣͨ��H2����
��3����������ϡ���ᷴӦ�Ƶõ�H2�л���HCl��H2O��g����HCl��H2O��g��������Na2O2��Ӧ������̽��Na2O2��H2�ķ�Ӧ����ʯ�ҵ������dz�ȥH2�е�HCl��H2O��g����
��4���������������Ա仯��Na2O2��H2�����²���Ӧ��������Na2O2�ۻ�����ɫ��ĩ��ɰ�ɫ�������������ͭδ�����ɫ��˵����Ӧû������H2O��˵��Na2O2��H2����ʱ��Ӧ����NaOH����Ӧ�Ļ�ѧ����ʽΪNa2O2+H2![]() 2NaOH��
2NaOH��

 ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�����Ŀ��������Ҫ����ɫ����֮һ����������һ�㺬��Fe��Cu�������ᡢ����Һ��Ӧ�IJ��������ʶ�Ӱ��ʹ�ã��ֶԴ��������ᴿ������ķ�Ӧ�������£�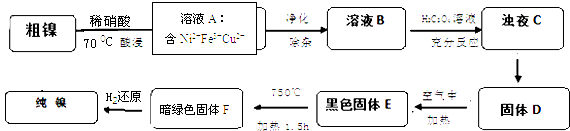
��֪��
��2Ni2O3����ɫ�� ![]() 4NiO����ɫ��+O2��
4NiO����ɫ��+O2��
��
���� | CuS | Cu��OH��2 | Ni��OH��2 | NiS |
Ksp | 8.8��10��38 | 2.2��10��20 | 5.48��10��18 | 3.2��1018 |
������Ϣ�ش�
��1��28Ni�����ڱ��еĵ����ڣ�����ϡ���ᷴӦ�����ӷ���ʽΪ �� ʵ��������Ľ��������¶��йأ������¶��������Ľ������������¶ȸ���70��ʱ�����Ľ������ֽ��ͣ���������Ni��OH��2����������ԭ��Ϊ��
��2������ҺA�ľ��������У��ȵ���PH=5.5���������5min������һ��ʱ����˳�Fe��OH��3 �� Ϊ�˵õ���������ҺB����Ҫ���������������г��ӣ�����ȷ�𰸱�ţ���
A.NaOH
B.Na2S
C.H2S
D.NH3�qH2O
��3����֪�����������ʵ��ܽ�ȹ�ϵ��NiC2O4��NiC2O4H2O��NiC2O42H2O������ҺC�õ�����D�IJ����������ˡ�������������ƣ��� D����E�Ļ�ѧ����ʽΪ
��4��1molE���������̵õ������������ϲμӷ�Ӧ������Ϊ mol��
��5���ⶨ��Ʒ�е��������Ļ���˼·�ǽ�Ni2+ת��Ϊ������ͨ������������������һ������Ni��������֪Ni2+����CO32�� �� C2O42����S2���������γɳ��������ⶨʱ��ѡ�ö���ͪ뿣�C4H8N2O2���������������ɷ���ʽΪC8H14N4O4Ni���ʺ�ɫ��������ʵ�����Ƕȷ�����Ҫԭ��Ϊ�� ��