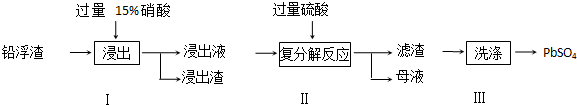
题目内容
4.写出Na2O2与水反应的分步反应式和总反应式,以及标出电子转移方向和数目、氧化剂、还原剂、氧化产物、还原产物,若2mol Na2O2与水反应,转移多少电子,生成多少O2?那生成0.5mol O2又需要多少Na2O2?分析 过氧化钠与水反应生成氢氧化钠和过氧化氢,过氧化氢不稳定分解生成水和氧气,氧化还原反应的实质是电子转移,化合价降低元素所在的反应物是氧化剂,发生还原反应,元素失去电子化合价升高,化合价升高数=化合价降低数=转移电子数.
解答 解:第一步是Na2O2+2H2O=2NaOH+H2O2,第二步反应的化学方程式为:2H2O2 ═2H2O+O2↑,总的反应方程式为:2H2O+2Na2O2=4NaOH+O2↑,电子转移方向和数目为: ,氧化剂是过氧化钠、还原剂是过氧化钠、氧化产物是氧气、还原产物是氢氧化钠,若2mol Na2O2与水反应,转移2mol电子,生成是1molO2,因为生成1mol的氧气需2mol的过氧化钠,而生成0.5mol O2需1mol的过氧化钠,答:第一步是Na2O2+2H2O=2NaOH+H2O2,第二步反应的化学方程式为:2H2O2 ═2H2O+O2↑,总的反应方程式为:2H2O+2Na2O2=4NaOH+O2↑,电子转移方向和数目为:
,氧化剂是过氧化钠、还原剂是过氧化钠、氧化产物是氧气、还原产物是氢氧化钠,若2mol Na2O2与水反应,转移2mol电子,生成是1molO2,因为生成1mol的氧气需2mol的过氧化钠,而生成0.5mol O2需1mol的过氧化钠,答:第一步是Na2O2+2H2O=2NaOH+H2O2,第二步反应的化学方程式为:2H2O2 ═2H2O+O2↑,总的反应方程式为:2H2O+2Na2O2=4NaOH+O2↑,电子转移方向和数目为: ,氧化剂是过氧化钠、还原剂是过氧化钠、氧化产物是氧气、还原产物是氢氧化钠,生成是1molO2,而生成0.5mol O2需1mol的过氧化钠.
,氧化剂是过氧化钠、还原剂是过氧化钠、氧化产物是氧气、还原产物是氢氧化钠,生成是1molO2,而生成0.5mol O2需1mol的过氧化钠.
点评 本题结合过氧化钠考查学生氧化还原反应中的基本概念知识,要求学生熟记教材知识,灵活应用.

| A. | 共价化合物中不可能含有离子键 | |
| B. | 只有金属元素和非金属元素才能形成离子键 | |
| C. | 水分子很稳定,因为水分子间存在氢键 | |
| D. | 所有的分子晶体内都存在两种以上作用力 |
在相同温度下,体积均为1 L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应。平衡时有关数据如下(已知2SO2(g)+O2(g)  2SO3(g)ΔH=-196.6 kJ·mol-1)。
2SO3(g)ΔH=-196.6 kJ·mol-1)。
容器 | 甲 | 乙 | 丙 | 丁 |
起始投料量 | 2molSO2 1mol O2 | 1 mol SO2 0.5mol O2 | 2mol SO3 | 2mol SO2 2mol O2 |
反应放出或吸收的热量(kJ) | a | b | c | d |
平衡时c(SO3) (mol·L-1) | e | f | g | h |
下列关系正确的是( )
A.a=c;e=g B.a>2b;e>2f C.a>d;e>h D.c+98.3e>196.6
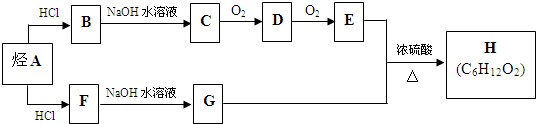

 .(用结构简式表示)
.(用结构简式表示) CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.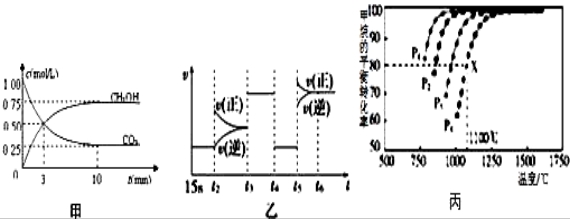
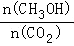 增大的是___________.
增大的是___________. 条件是_____________.(填序号)
条件是_____________.(填序号) 转化率
转化率