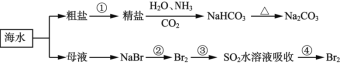
题目内容
【题目】下列有关实验现象、解释和结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 |
B | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | 酸的强弱:HX<HY |
C | 常温下,用pH计分别测定0.1moI/LNaA溶液的0.1moI/LNaB溶液的pH | pH:NaA>NaB | 能证明酸性:HA>HB |
D | 向盛有1mL0.lmol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1mol/L的NaI溶液,再振荡, | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
【答案】B
【解析】
A.气体红棕色变深,说明NO2浓度增大,升高温度,平衡逆向移动,升高温度,平衡向吸热方向移动,因此正反应为放热反应,正反应的△H<0,故A错误;
B.等pH时,HX放出的氢气多且反应速率快,则说明HX中所含总H+更多,即HX的酸性较HY弱,故B正确;
C.根据“越弱越水解”可知,酸性:HA<HB,故C错误;
D.滴加10滴0.1mol/L的NaCl溶液产生白色沉淀,再加入0.1mol/L的NaI溶液,硝酸银过量,不存在沉淀转化,因此不能比较Ksp(AgI)、Ksp(AgCl)的大小,故D错误;
故答案为:B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目