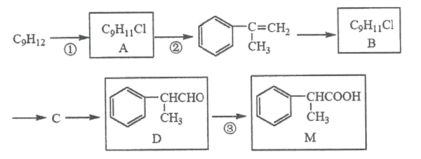
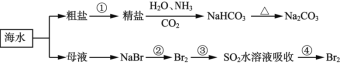
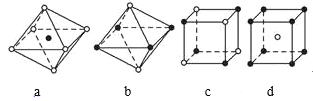
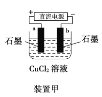
题目内容
【题目】对于合成氨N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-92.4 kJ·mol-1反应,达到平衡后,以下分析正确的是
2NH3(g)ΔH=-92.4 kJ·mol-1反应,达到平衡后,以下分析正确的是
A. 升高温度,对正反应的反应速率影响更大
B. 增大压强,对正反应的反应速率影响更大
C. 减小反应物浓度,对逆反应的反应速率影响更大
D. 加入催化剂,对逆反应的反应速率影响更大
【答案】B
【解析】针对合成氨N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-92.4 kJ·mol-1反应,
2NH3(g)ΔH=-92.4 kJ·mol-1反应,
A.正反应为放热反应,升高温度,平衡逆向移动,逆向速率大于正向速率,故对正反应的反应速率影响小,故错误;
B. 增大压强,平衡正向移动,正速率大于逆向向速率,对正反应的反应速率影响更大,故正确;
C. 减小反应物浓度,平衡逆向移动,正反应速率瞬间减小,对正反应的反应速率影响更大,故错误;
D. 加入催化剂,对正逆、反应的反应速率影响一样大,故错误。故选B。

练习册系列答案
相关题目
【题目】已知X、Y、Z、W为原子序数依次增大的四种短周期主族元素,前三种元素原子的电子层数相同,Y、W元素原子的最外层电子数相同。表给出了四种元素的部分信息,则下列说法正确的是
元素 | X | Y | Z | W |
原子半径/nm | 0.134 | r1 | r2 | 0.106 |
A.r1>r2>0.106
B.0.134<r1<r2
C.0.134>r1>r2
D.电子层数多的元素的原子半径一定比较大