题目内容
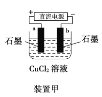
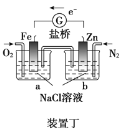
【题目】燃料电池的优点有能量转化效率高、无污染等。下图是乙醇燃料电池(BFC)的示意图,a、b为置于多孔陶瓷管中的纳米碳纤维电极。下列有关该电池的说法不正确的是
A.电子由a极经外电路导线流向b极
B.b极的电极反应式为:O2+4H++4e-=2H2O
C.该电池的总反应式为:C2H5OH+3O2+4KOH=2K2CO3+5H2O
D.用该电池电镀铜时,若待镀金属增重12.8 g,至少消耗标准状况下的氧气2.24 L
【答案】B
【解析】
根据装置图可知通入燃料乙醇的a电极为负极,通入O2的b电极为正极。
A.根据图示可知,通入燃料乙醇的电极为负极,失去电子发生氧化反应,电子由负极a电极经外电路导线流向b极,A正确;
B.在正极b上,溶液为碱性,不可能含有大量H+,O2获得电子,发生还原反应,产生OH-,电极反应式为:O2+4e-+2H2O=4OH-,B错误;
C.电池负极发生反应:C2H5OH-12e-+14OH-=2CO32-+7H2O,正极的电极反应式为:O2+4e-+2H2O=4OH-,所以该电池的总反应式为:C2H5OH+3O2+4KOH=2K2CO3+5H2O,C正确;
D.用该电池电镀铜时,若待镀金属增重12.8 g,n(Cu)=12.8g÷64g/mol=0.2mol,由于Cu是+2价的金属,所以电子转移的物质的量是n(e-)=0.2mol×2=0.4mol,由于1molO2反应转移4mol电子,所以转移0.4mol电子,消耗氧气0.1mol,则消耗的O2在标准状况下体积V(O2)=0.1mol×22.4L/mol=2.24 L,反应物不可能完全发生反应,因此消耗的氧气的体积在标准情况下大于2.24L,D正确;
故合理选项是B。

【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ.探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Z剧烈 |
2、各取1.0g的金属Z和金属Y(形状相同),分别加入到5mL1.0mol/L盐酸中。 | 金属Z与盐酸反应比金属Y剧烈 |
通过实验验证三种元素金属性由强到弱是_____,则下列判断正确的是(__________)
A.原子序数:Y>Z>X B.原子的最外层电子数X>Y>Z
C.原子半径:Y>Z>X D.Y的最高价氧化物对应水化物的碱性最强
Ⅱ.探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
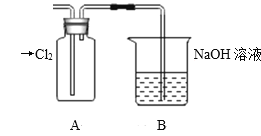
(1)装置A中盛放的试剂是_______(填选项),化学反应方程式是_________。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
A.HCl比H2S稳定
B.HClO氧化性比H2SO4强
C.HClO4酸性比H2SO4强
D.铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用原子结构理论解释非金属性Cl>I的原因:同主族元素从上到下,________________。