题目内容
12.已知某烷烃中的碳氢质量比为5:1(1)确定该烷烃的分子式,计算烷烃的相对分子质量
(2)写出该烷烃在空气中燃烧的化学反应方程式
(3)如果该烷烃的一氯取代物只有1种,写出该烷烃的结构简式.
分析 (1)某烷烃中的碳氢质量比为5:1,则其分子中含有C、H原子数之比为:$\frac{5}{12}$:$\frac{1}{1}$=5:12,最简式为C5H12,该最简式中H已经达到饱和,则该烷烃的分子式即为其最简式;根据分子式确定其相对分子质量;
(2)戊烷在空气中燃烧生成二氧化碳气体和水,据此写出反应的化学方程式;
(3)该烷烃的一氯取代物只有1种,数目该烷烃分子中所有H原子都等效,为新戊烷.
解答 解:(1)某烷烃中的碳氢质量比为5:1,则其分子中含有C、H原子数之比为:$\frac{5}{12}$:$\frac{1}{1}$=5:12,最简式为C5H12,该最简式中H已经达到饱和,则该烷烃的分子式为:C5H12,其相对分子质量为:12×5+1×12=72,
答:该烷烃的分子式为C5H12,计算烷烃的相对分子质量为72;
(2)戊烷在空气中完全燃烧生成二氧化碳和水,反应的化学方程式为:C5H12+8O2$\stackrel{点燃}{→}$5CO2+6H2O,
答:戊烷在空气中燃烧的方程式为C5H12+8O2$\stackrel{点燃}{→}$5CO2+6H2O;
(3)分子式为C5H12的烷烃为戊烷,戊烷存在正戊烷、异戊烷和新戊烷三种同分异构体,该烷烃的一氯取代物只有1种,则戊烷分子中所有H原子都等效,该戊烷为新戊烷,其结构简式为: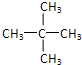 ,
,
答:该烷烃的结构简式为 .
.
点评 本题考查了有机物分子式、结构简式的确定、有机反应方程式书写,题目难度中等,注意掌握常见有机物结构与性质,明确同分异构的书写原则,能够正确书写常见有机反应方程式.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
1.下列说法正确的是( )
| A. | 水、双氧水、水玻璃都是纯净物 | B. | 乙醚和乙醇互为同分异构体 | ||
| C. | 乙醇、氯气、葡萄糖都是非电解质 | D. | 甲酸与硬脂酸属于同系物 |
2.下列关于Fe2(SO4)3的叙述正确的是(设NA为阿伏加德罗常数的数值)( )
| A. | 1mol/L的 Fe2(SO4)3溶液中含有2NA个Fe3+(不考虑水解) | |
| B. | 1mol的 Fe2(SO4)3和S2-反应可转移2NA个电子 | |
| C. | 在该溶液中,K+、NH4+、I-、SO42-可以大量共存 | |
| D. | 与Cu反应的离子方程式为:Fe3++Cu═Fe2++Cu2+ |
7.某学习小组对“部分酸碱盐溶解性表”中碳酸亚铁的性质设计实验探究.
(一)制备碳酸亚铁.
将一定量新制备的硫酸亚铁溶液和过量的碳酸氢铵溶液混合产生大量沉淀和气体.
(1)写出离子方程式:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(二)探究碳酸亚铁的热稳定性(加热仪器省略)
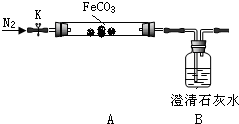
连接仪器、装药品.打开K,先通入一段时间氮气,然后,用酒精喷灯在A处加热玻璃管,观察B瓶溶液变浑浊.待固体分解完后,继续通入氮气至玻璃管冷却.
(2)先通入氮气的目的是排尽装置内空气,避免氧气干扰.B瓶现象能说明分解产物有二氧化碳.
(3)停止加热之前,是否拆开A、B之间橡胶管?答:否;理由是通入氮气,玻璃管内气压不会减小.
(三)探究碳酸亚铁还原性
【查阅资料】①氧化亚铁是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁.②碳酸亚铁在空气中灼烧生成氧化铁.
(4)探究碳酸亚铁和氧气反应后的固体成分:
【提出设想】假设1 固体成分是氧化铁;
假设2 固体成分是四氧化三铁;
假设3氧化铁和四氧化三铁.
请设计实验验证假设一(限选试剂:2.00mol/L的H2SO4、HCI、HNO3;KSCN溶液、KMnO4溶液、NaOH溶液、H2O2溶液)
(5)定量探究:取23.2g纯净固体碳酸亚铁,在空气中高温灼烧至恒重,称得固体质量净减少7.2g.通过计算确定固体成分是氧化铁.
(一)制备碳酸亚铁.
将一定量新制备的硫酸亚铁溶液和过量的碳酸氢铵溶液混合产生大量沉淀和气体.
(1)写出离子方程式:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(二)探究碳酸亚铁的热稳定性(加热仪器省略)

连接仪器、装药品.打开K,先通入一段时间氮气,然后,用酒精喷灯在A处加热玻璃管,观察B瓶溶液变浑浊.待固体分解完后,继续通入氮气至玻璃管冷却.
(2)先通入氮气的目的是排尽装置内空气,避免氧气干扰.B瓶现象能说明分解产物有二氧化碳.
(3)停止加热之前,是否拆开A、B之间橡胶管?答:否;理由是通入氮气,玻璃管内气压不会减小.
(三)探究碳酸亚铁还原性
【查阅资料】①氧化亚铁是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁.②碳酸亚铁在空气中灼烧生成氧化铁.
(4)探究碳酸亚铁和氧气反应后的固体成分:
【提出设想】假设1 固体成分是氧化铁;
假设2 固体成分是四氧化三铁;
假设3氧化铁和四氧化三铁.
请设计实验验证假设一(限选试剂:2.00mol/L的H2SO4、HCI、HNO3;KSCN溶液、KMnO4溶液、NaOH溶液、H2O2溶液)
| 实验步骤 | 预期现象和结论 |
4.下列有关说法正确的是( )
| A. | 镀铜铁制品受损后,铁制品比受损前更容易生锈 | |
| B. | 其他条件不变时,降低温度可使铁与稀盐酸反应的速率增大 | |
| C. | T℃时,反应A(g)+3B(g)?2C(g)达平衡后时,A的生成速率与C的生成速率相等 | |
| D. | 在密闭容器中反应aA(g)?bB(g)达平衡后,保持温度不变,将容器容积增加一倍,当达到新平衡时,B的浓度是原来的60%,则a=b |
1.草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如表:
(1)为证明草酸受热分解的产物中含有CO2和CO(部分夹持仪器和加热装置省略),某课题小组设计实验如下:
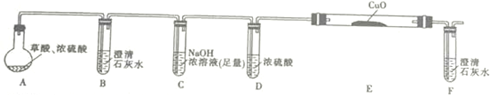
①写出E中反应的化学方程式并用双线桥标明电子转移的方向和数目: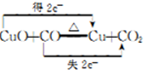 .
.
②用上图提供的仪器和试剂做实验时,装置B中出现白色浑浊,也不能说明一定有CO2,请你提出改进意见:在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管).
③利用改进后的装置进行实验时,要先加热A(填“A”“B”“C”“D”“E”或“F”,下同)装置,后加热E装置.
(2)该小组同学利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需的时间来判断反应的快慢.该小组设计了如下方案:
①已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥2.5(或5:2).
②探究温度对化学反应速率影响的实验编号是Ⅱ和Ⅲ;探究反应物浓度对化学反应速率影响的实验编号是I和Ⅱ.
| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 二元弱酸,有毒,具有腐蚀性,易溶于水,100℃开始升华,157℃时开始分解,与浓硫酸混合加热会产生CO2、CO和H2O,草酸钙和草酸氢钙均为白色不溶物 |

①写出E中反应的化学方程式并用双线桥标明电子转移的方向和数目:
 .
.②用上图提供的仪器和试剂做实验时,装置B中出现白色浑浊,也不能说明一定有CO2,请你提出改进意见:在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管).
③利用改进后的装置进行实验时,要先加热A(填“A”“B”“C”“D”“E”或“F”,下同)装置,后加热E装置.
(2)该小组同学利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需的时间来判断反应的快慢.该小组设计了如下方案:
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| Ⅰ | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅱ | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅲ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
②探究温度对化学反应速率影响的实验编号是Ⅱ和Ⅲ;探究反应物浓度对化学反应速率影响的实验编号是I和Ⅱ.
 某化学学习小组同学根据实验室现有的制取氨气的药品,设计了如图所示的实验装置(部分夹持仪器未画出),制取并探究氨气的还原性、检验反应产物.请回答下列问题:
某化学学习小组同学根据实验室现有的制取氨气的药品,设计了如图所示的实验装置(部分夹持仪器未画出),制取并探究氨气的还原性、检验反应产物.请回答下列问题: