题目内容
2.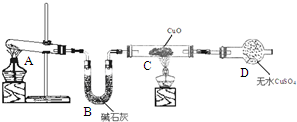 某化学学习小组同学根据实验室现有的制取氨气的药品,设计了如图所示的实验装置(部分夹持仪器未画出),制取并探究氨气的还原性、检验反应产物.请回答下列问题:
某化学学习小组同学根据实验室现有的制取氨气的药品,设计了如图所示的实验装置(部分夹持仪器未画出),制取并探究氨气的还原性、检验反应产物.请回答下列问题:(1)A中发生反应的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)B中碱石灰的作用是干燥氨气.
(3)C中黑色固体变红,且产生的气体对空气无污染,写出该反应的化学方程式;D中发生的现象是无水硫酸铜变蓝.
(4)该装置存在明显缺陷,该缺陷是此装置无有尾气吸收装置,NH3排入大气,污染环境.
(5)工业中常用氮气与氢气在高温、高压、铁触媒做催化剂的条件下合成氨气,该小组同学模拟该条件也合成出了氨气.已知起始时,将2molN2、6molH2充入一个容积为2L的密闭容器中发生反应,过了5min后,混合气体的总物质的量减少了1mol,求在这段时间内以H2表示的化学反应速率为0.15mol/(L•min).
分析 (1)实验室用氯化铵和氢氧化钙加热制取氨气;
(2)制得的氨气中含有水份,可以用碱石灰干燥;
(3)根据元素守恒写出反应方程式,再根据生成物判断实验现象;
(4)根据氨气的性质结合题中装置图分析判断;
(5)将2molN2、6molH2充入一个容积为2L的密闭容器中发生反应,过了5min后,混合气体的总物质的量减少了1mol,根据合成氨的方程式N2+3H2?2NH3,可知有0.5mol氢气参加了反应,根据$v=\frac{△c}{t}$计算反应速率;
解答 解:(1)实验室用氯化铵和氢氧化钙加热制取氨气,反应的方程式为2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)制得的氨气中含有水份,可以用碱石灰干燥,所以碱石灰的作用是干燥氨气,
故答案为:干燥氨气;
(3)C中黑色固体变红,且产生的气体对空气无污染,该反应的化学方程式为3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O;C中产生的水能使D无水硫酸铜呈蓝色,所以D中发生的现象是无水硫酸铜变蓝,
故答案为:3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O;无水硫酸铜变蓝;
(4)氨气是刺激性气体,所以不能排空,应有尾气处理装置,
故答案为:此装置无有尾气吸收装置,NH3排入大气,污染环境;
(5)将2molN2、6molH2充入一个容积为2L的密闭容器中发生反应,过了5min后,混合气体的总物质的量减少了1mol,根据合成氨的方程式N2+3H2?2NH3,可知有1.5mol氢气参加了反应,根据$v=\frac{△c}{t}$可知,以H2表示的反应速率为$\frac{\frac{1.5mol}{2L}}{5min}$=0.15 mol/(L•min),
故答案为:0.15 mol/(L•min).
点评 本题考查了氨气的性质和制取,难度不大,会根据题中信息设计实验,实验设计是高考的热点和难点.

| A. | 简单立方 | B. | 钾型 | C. | 镁型 | D. | 铜型 |
| A. | 10 g H2和10 g O2 | B. | 5.6 L N2(标准状况)和22 g CO2 | ||
| C. | 9 g H2O和0.5 mol Br2 | D. | 224 mL H2和0.01 mol N2 |
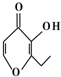 央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | 该有机物遇FeCl3溶液显紫色 | |
| B. | 1mol该有机物最多能与3 mol H2发生加成反应 | |
| C. | 该有机物能发生取代、加成、氧化和消去反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
| A. | Fe2O3是还原剂 | B. | Al被还原 | ||
| C. | Fe2O3发生还原反应 | D. | 反应中转移3个电子 |
| A. | 用pH试纸测定溶液的pH之前,要先用蒸馏水湿润 | |
| B. | 若用水湿润过的pH试纸去测定盐酸的pH,结果偏小 | |
| C. | 若用水湿润过的pH试纸去测定氢氧化钠溶液的pH,结果偏小 | |
| D. | 新制氯水呈酸性,所以只能使pH试纸变红 |
| A. | 甲烷 | B. | 氟氯代烃 | C. | 二氧化碳 | D. | 二氧化硫 |
| A. | 用水鉴别乙醇、苯、溴苯 | |
| B. | 用Ba(OH)2溶液鉴别硫酸钠和亚硫酸钠 | |
| C. | 用溴水鉴别甲烷和乙烯 | |
| D. | 通过烧焦时的特殊气味鉴别纯毛和纯棉 |