题目内容
4.下列有关说法正确的是( )| A. | 镀铜铁制品受损后,铁制品比受损前更容易生锈 | |
| B. | 其他条件不变时,降低温度可使铁与稀盐酸反应的速率增大 | |
| C. | T℃时,反应A(g)+3B(g)?2C(g)达平衡后时,A的生成速率与C的生成速率相等 | |
| D. | 在密闭容器中反应aA(g)?bB(g)达平衡后,保持温度不变,将容器容积增加一倍,当达到新平衡时,B的浓度是原来的60%,则a=b |
分析 A.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护;
B.降低温度会减慢反应速率;
C.达到平衡状态时,不同物质的正逆反应速率之比等于计量数之比;
D.先假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,比假设大,说明平衡向生成B的方向移动.
解答 解:A.镀铜铁制品受损后,Fe、Cu形成原电池时Fe为负极被腐蚀,所以铁制品比受损前更容易生锈,故A正确;
B.降低温度会减慢反应速率,所以其他条件不变时,降低温度可使铁与稀盐酸反应的速率减小,故B错误;
C.达到平衡状态时,不同物质的正逆反应速率之比等于计量数之比,则达平衡后时,A的生成速率与C的生成速率的$\frac{1}{2}$,故C错误;
D.先假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,比假设大,说明平衡向生成B的方向移动,即减小压强平衡向正反应方向移动,则a<b,故D错误.
故选A.
点评 本题考查了原电池原理的应用、影响反应速率的因素、化学平衡状态、平衡移动,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
14.X和Y是短周期元素,两者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数不可能是( )
| A. | n+11 | B. | n-5 | C. | n+3 | D. | n+5 |
9.化学与生活密切相关,下列有关说法正确的是( )
| A. | 煤的干馏和石油的分馏都属化学变化 | |
| B. | 硫酸钡在医学上用作钡餐,钡离子对人体无害 | |
| C. | 碳-14可用作文物年代的鉴定,碳-14与碳-12互为同素异形体 | |
| D. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
13.金属锌(Zn)形成金属晶体,其金属原子堆积属于下列( )模式.
| A. | 简单立方 | B. | 钾型 | C. | 镁型 | D. | 铜型 |
14.下列有关pH试纸的描述正确的是( )
| A. | 用pH试纸测定溶液的pH之前,要先用蒸馏水湿润 | |
| B. | 若用水湿润过的pH试纸去测定盐酸的pH,结果偏小 | |
| C. | 若用水湿润过的pH试纸去测定氢氧化钠溶液的pH,结果偏小 | |
| D. | 新制氯水呈酸性,所以只能使pH试纸变红 |
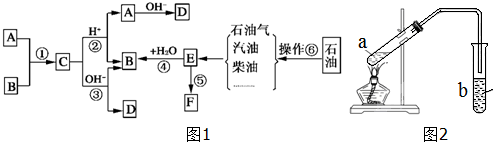
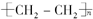 ?+3nO2$\stackrel{点燃}{→}$2nCO2+2nH2O.
?+3nO2$\stackrel{点燃}{→}$2nCO2+2nH2O.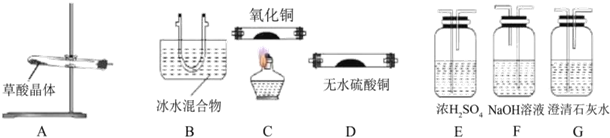
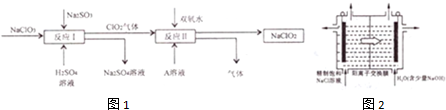
 HClO2+OH-(用离子方程式表示).
HClO2+OH-(用离子方程式表示).