题目内容
【题目】Fe是日常生活中最常用的金属之一。回答下列问题:
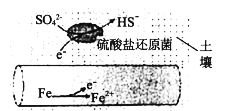
(1)深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(该还原菌最佳生存环境在pH为7~8之间)作用下,能被SO42-腐蚀,其电化学腐蚀原理如下图所示,写出正极的电极反应式___________________。
(2)在1800K时,2Fe(s)+3/2O2(g)=Fe2O3(s) H=-354.2kJ/mol;3Fe(s)+2O2(g)=Fe3O4(s) H=-550.9kJ/mol则反应:2Fe3O4(s)+1/2O2(g) ===3Fe2O3(s)的H为_____ kJ·mol1,四氧化三铁在充满氧气的集气瓶中反应生成Fe2O3_____(填“能”或“不能”)自发进行。
(3)Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+![]() 2Fe2+ +I2(在水溶液中)。
2Fe2+ +I2(在水溶液中)。
①298K时,向5mL 0.1molL1 的KI溶液中滴加0.1molL1 FeCl3溶液,得到c(Fe2+)与加入FeCl3 溶液体积关系如下图所示:
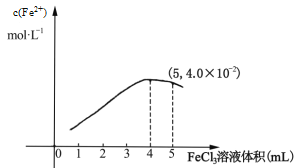
该温度下滴加5mL FeCl3溶液时,Fe3+的平衡转化率=_____%,平衡常数K=_____,若要提高Fe3+的转化率,可采取的措施是________________________。
②在已经达到平衡的上述反应体系中,加入苯对I2进行萃取,保持温度不变,反应速率_____ (填“增大”、“减小”或“不变”),此时υ(正)_____υ(逆)(填“大于”、“小于”或“等于”)。
③υ(正)与Fe3+、I的浓度关系为υ=kc(I-)mc(Fe3+)n(k为常数)
c(I)molL1 | c(Fe3+)molL1 | υ (molL1s1 ) | |
(1) | 0.20 | 0.80 | 0.032k |
(2) | 0.60 | 0.40 | 0.144k |
(3) | 0.80 | 0.20 | 0.128k |
通过分析所给数据计算可知:在υ=kc(I-)mc(Fe3+)n 中,m,n的值为_____(填字母代号)。
A.m=1,n=1 B.m=2,n=1 C.m=2,n=2 D.m=1,n=2
【答案】SO42-+5H2O+8e-=HS-+9OH- +39.2 不能 80 3200 增大I-的浓度 减小 大于 B
【解析】
(1)根据图示,正极得电子,发生还原反应,电极反应为:SO42-+5H2O+8e-=HS-+9OH-;
(2)根据盖斯定律,由已知两个热化学方程式得:2Fe3O4(s) +![]() O2(g)=3Fe2O3(s) 的H=-2
O2(g)=3Fe2O3(s) 的H=-2![]() H2+3
H2+3![]() H1=-2
H1=-2![]() (550.9 kJmol-1)+3
(550.9 kJmol-1)+3![]() (354.2 kJmol-1)=+39.2kJmol-1;反应为混乱度减小的反应,且反应是吸热,所以该反应不能自发进行;
(354.2 kJmol-1)=+39.2kJmol-1;反应为混乱度减小的反应,且反应是吸热,所以该反应不能自发进行;
(3) ①由图示可知,平衡时c(Fe2+)=4.0×10-2 molL 1,则Fe3+的平衡转化率(×mol/L×10mL)÷(mol/L×5mL)×100%=80%;平衡时2I-+ 2Fe3+![]() 2Fe2+ + I2平衡常数K=
2Fe2+ + I2平衡常数K=![]() =(4×10-2)2×(2×10-2)÷[(1×10-2)2×(1×10-2)2]=3200;若要提高 Fe3+的转化率, 可采取的措施是:增大I-的浓度;故答案为:80;3200;增大I-的浓度;
=(4×10-2)2×(2×10-2)÷[(1×10-2)2×(1×10-2)2]=3200;若要提高 Fe3+的转化率, 可采取的措施是:增大I-的浓度;故答案为:80;3200;增大I-的浓度;
②加入苯对 I2进行萃取使生成物浓度减小,反应速率减小,平衡向正反应方向移动,故正反应速率大于逆反应速率;故答案为:减小;大于;
③将表中的三组数据代入公式υ=kc(I-)mc(Fe3+)n,可得:
0.20m×0.80n=0.032k,0.60m×0.40n=0.144k,0.80m×0.20n=0.128k,
解得:m=2,n=1,
故答案为:B。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案