题目内容
【题目】铝和氟的化合物在制造、化工等领域都有广泛应用。回答下列问题:
(1)基态铝原子的核外电子排布式为___________,占据最高能级的电子的电子云轮廓图形状为___________,基态铝原子比基态镁原子的第一电离能(I1)小,其原因是___________。
(2)通常情况下,AlF3可由六氟铝酸铵[(NH4)3AlF6]受热分解制得,请写出该反应的化学方程式______________________。
(3)AlF3具有较高的熔点(1040℃),属于___________晶体(填晶体类型);AlCl3在178℃时升华,写出导致AlF3、AlCl3具有不同晶体类型的原因(从原子结构与元素性质的角度作答)___________。
(4)NaAlO2在水溶液中实际上都是以Na[Al(OH)4]形式存在。其中[Al(OH)4]-为配离子,写出Al原子的杂化形式___________,该阴离子中存在的化学键有___________(填字母代号)
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位健 F.氢键
(5)萤石CaF2晶体的晶胞如图所示,其中Ca2+的堆积方式称为___________。立方体边长为acm,阿伏加德罗常数的值为NA,则CaF2晶体的密度为___________g·cm-3(列出计算式)

【答案】![]() 纺锤型(哑铃型) 镁原子的3s轨道为全充满,3p轨道为全空,稳定性强,因此镁原子的第一电离能大于铝
纺锤型(哑铃型) 镁原子的3s轨道为全充满,3p轨道为全空,稳定性强,因此镁原子的第一电离能大于铝 ![]() 离子 F的电负性强于Cl,更容易得电子形成离子键而形成离子晶体 sp3 B、E 面心立方
离子 F的电负性强于Cl,更容易得电子形成离子键而形成离子晶体 sp3 B、E 面心立方 ![]()
【解析】
(1)根据核外电子排布规律得基态铝原子的核外电子排布式为1s22s22p63s23p1; p轨道的电子云轮廓图形状为纺锤型; 基态铝原子比基态镁原子的第一电离能(I1)小, 其原因是镁原子的3s轨道为全充满,3p轨道为全空,稳定性强,因此镁原子的第一电离能大于铝;故答案为:1s22s22p63s23p1,纺锤型,镁原子的3s轨道为全充满,3p轨道为全空,稳定性强,因此镁原子的第一电离能大于铝;
(2)根据题干信息 AlF3 可由六氟铝酸铵[(NH4)3AlF6]受热分解制得,反应的化学方程式为: (NH4)3AlF6=3NH3↑+3HF↑+AlF3;
(3) 因为AlF3具有较高的熔点,且F非金属性强,则AlF3属于离子晶体; AlCl3 为分子晶体,它们的差异原因在于:F的电负性强于Cl,更容易得电子形成离子键而形成离子晶体;
(4)[Al(OH)4]-的配位数为4,则 Al 原子的杂化形式是sp3 ; 该阴离子中存在的化学键有极性键和配位键,故答案为:sp3,B、E;
(5)根据萤石的晶胞图所示,其中Ca2+的堆积方式称为面心立方;晶胞中Ca2+数目为:8![]() 4,F-数目为8,则晶胞的密度为:
4,F-数目为8,则晶胞的密度为:![]() =
=![]() =
=![]() g/cm3。
g/cm3。

【题目】Fe是日常生活中最常用的金属之一。回答下列问题:
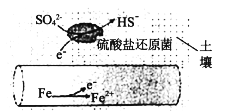
(1)深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(该还原菌最佳生存环境在pH为7~8之间)作用下,能被SO42-腐蚀,其电化学腐蚀原理如下图所示,写出正极的电极反应式___________________。
(2)在1800K时,2Fe(s)+3/2O2(g)=Fe2O3(s) H=-354.2kJ/mol;3Fe(s)+2O2(g)=Fe3O4(s) H=-550.9kJ/mol则反应:2Fe3O4(s)+1/2O2(g) ===3Fe2O3(s)的H为_____ kJ·mol1,四氧化三铁在充满氧气的集气瓶中反应生成Fe2O3_____(填“能”或“不能”)自发进行。
(3)Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+![]() 2Fe2+ +I2(在水溶液中)。
2Fe2+ +I2(在水溶液中)。
①298K时,向5mL 0.1molL1 的KI溶液中滴加0.1molL1 FeCl3溶液,得到c(Fe2+)与加入FeCl3 溶液体积关系如下图所示:

该温度下滴加5mL FeCl3溶液时,Fe3+的平衡转化率=_____%,平衡常数K=_____,若要提高Fe3+的转化率,可采取的措施是________________________。
②在已经达到平衡的上述反应体系中,加入苯对I2进行萃取,保持温度不变,反应速率_____ (填“增大”、“减小”或“不变”),此时υ(正)_____υ(逆)(填“大于”、“小于”或“等于”)。
③υ(正)与Fe3+、I的浓度关系为υ=kc(I-)mc(Fe3+)n(k为常数)
c(I)molL1 | c(Fe3+)molL1 | υ (molL1s1 ) | |
(1) | 0.20 | 0.80 | 0.032k |
(2) | 0.60 | 0.40 | 0.144k |
(3) | 0.80 | 0.20 | 0.128k |
通过分析所给数据计算可知:在υ=kc(I-)mc(Fe3+)n 中,m,n的值为_____(填字母代号)。
A.m=1,n=1 B.m=2,n=1 C.m=2,n=2 D.m=1,n=2
【题目】某合金与铁的物理性质的比较如下表所示:(注:硬度以金刚石为10作标准,导电性以银的导电性100为标准)
熔点 | 密度 | 硬度 | 导电性 | |
某合金 | 32000C | 3.20g/cm3 | 7.5 | 3.5 |
铁 | 15350C | 7.86g/cm3 | 4.5 | 17 |
已知该合金耐腐蚀、强度大,从性能看,该合金不适合制
A.门窗框B.炉具C.电源线D.飞机外壳
【题目】由下列实验操作及现象能得出相应结论的是
操作 | 现象 | 结论 | |
A. | 将蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 该溶液一定为浓盐酸 |
B. | 向 CH3COONa 溶液中滴入酚酞试液,加热 | 加热后红色加深 | CH3COONa 水解是吸热反应 |
C. | 向某溶液中加入盐酸,将产生 的气体通入澄清石灰水 | 澄清石灰水变浑浊 | 该溶液中一定有 CO32— |
D. | 向 NaCl 溶液中滴加过量 AgNO3 溶液,再滴加 KI 溶液 | 先出现白色沉淀, 后出现黄色沉淀 | Ksp(AgI) < Ksp(AgCl) |
A. A B. B C. C D. D