ЬтФПФкШн
ЁОЬтФПЁПФмдДЪЧШЫРрЩњДцКЭЗЂеЙЕФживЊжЇжљЁЃИљОнвЊЧѓЛиД№ЯТСаЮЪЬтЁЃ
(1)ЯТСаЫЕЗЈжаДэЮѓЕФЪЧ______ЁЃ

AЃЎЖМЪЧЧхНрФмдД
BЃЎЕчФмЃЌH2ЪєгкЖўДЮФмдДЃЌЫЎСІЪЧвЛМЖФмдД
CЃЎУККЭЪЏгЭЪєгкЛЏЪЏШМСЯЃЌШМЩеЛсВњЩњЮТЪвЦјЬх
DЃЎЧтФмШШжЕИпЃЌЖдЛЗОГЮоЮлШО
(2)ЮвЙњФПЧАЪЙгУЕФжївЊФмдДЪЧЛЏЪЏШМСЯЃЌНќФъРДЮвЙњФмдДзмЯћЗбСПгыШЫОљФмдДЯћЗбСПШчЭМЁЃ
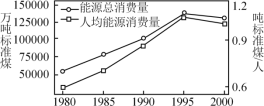
ЂйдкЮвЙњЃЌУКЕФЯћЗбСПОоДѓЃЌЧвУКЪєгкВЛПЩдйЩњФмдДЃЌбАеваТФмдДЪЧФмдДбаОПЕФжївЊПЮЬтжЎвЛЁЃЯТСаВЛЪєгкаТФмдДЕФЪЧ______ЁЃ
AЃЎЬЋбєФм BЃЎЧтФм CЃЎЕиШШФм DЃЎКЃбѓФм
EЃЎЩњЮяжЪФм FЃЎЪЏгЭ GЃЎЬьШЛЦј
ЂквбжЊЃЌ1 kgУКДѓдМЗХШШ2.9ЁС104 kJЁЃЗчФмФмСПОоДѓЃЌЕиЧђЩЯвЛФъПЩРћгУЕФЗчФмЯрЕБгк5ЁС1014 kwЁЄhЕФЕчФмЁЃЪдМЦЫуЃЌвЛФъЕФЗчФмШєФмШЋВПРћгУЃЌПЩЯрЕБгкНкЪЁ______ЖжШМУКЁЃ(вбжЊЃЌ1 kwЁЄhЃН3.6ЁС103 kJ)
ЁОД№АИЁПA FG 6.2ЁС1010
ЁОНтЮіЁП
ЧхНрФмдДЃЌМДТЬЩЋФмдДЃЌЪЧжИВЛХХЗХЮлШОЮяЁЂФмЙЛжБНггУгкЩњВњЩњЛюЕФФмдДЃЌЫќАќРЈКЫФмКЭЁАПЩдйЩњФмдДЁБЁЃаТФмдДвЛАуЪЧжИдкаТММЪѕЛљДЁЩЯМгвдПЊЗЂРћгУЕФПЩдйЩњФмдДЃЌАќРЈЬЋбєФмЁЂЩњЮяжЪФмЁЂЗчФмЁЂЕиШШФмЁЂВЈРЫФмЁЂЧтФмЁЂКЃбѓФмЕШЁЃ
ЃЈ1ЃЉAЃЎЧхНрФмдДЃЌМДТЬЩЋФмдДЃЌЪЧжИВЛХХЗХЮлШОЮяЁЂФмЙЛжБНггУгкЩњВњЩњЛюЕФФмдДЃЌЫќАќРЈКЫФмКЭЁАПЩдйЩњФмдДЁБЁЃвђДЫЛЏЪЏШМСЯКЭНЙТЏЦјВЛФмГЦЮЊЧхНрФмдДЃЌAЯюДэЮѓЃЛ
BЃЎЕчФмЃЌH2ЪЧгЩвЛДЮФмдДжЦБИЫљЕУЕФЖўДЮФмдДЃЌЫЎСІЪЧвЛМЖФмдДЃЌBЯюе§ШЗЃЛ
CЃЎУКЁЂЪЏгЭЁЂЬьШЛЦјОљЪєгкЛЏЪЏШМСЯЃЌШМЩеЪБЛсВњЩњЮТЪвЦјЬхЖўбѕЛЏЬМЃЌCЯюе§ШЗЃЛ
DЃЎЧтФмШШжЕИпЃЌЖдЛЗОГЮоЮлШОЃЌЪЧвЛжжРэЯыЕФаТФмдДЃЌDЯюе§ШЗЃЛ
Д№АИбЁAЁЃ
(2)
ЂйаТФмдДвЛАуЪЧжИдкаТММЪѕЛљДЁЩЯМгвдПЊЗЂРћгУЕФПЩдйЩњФмдДЃЌАќРЈЬЋбєФмЁЂЩњЮяжЪФмЁЂЗчФмЁЂЕиШШФмЁЂВЈРЫФмЁЂЧтФмЁЂКЃбѓФмЕШЃЌЖјУКЁЂЪЏгЭЁЂЬьШЛЦјОљЪєгкЛЏЪЏШМСЯВЛЪєгкаТФмдДЁЃвђДЫВЛЪєгкаТФмдДЕФгІбЁдёFGЃЛ
ЂквбжЊЃЌ1 kgУКДѓдМЗХШШ2.9ЁС104 kJЁЃвЛФъПЩРћгУЕФЗчФмЯрЕБгк5ЁС1014 kwЁЄhЕФЕчФмЃЌИљОн1 kwЁЄhЃН3.6ЁС103 kJЃЌПЩЛЛЫуГівЛФъПЩРћгУЕФЗчФмЬсЙЉЕФФмСПЮЊ5ЁС1014 kwЁЄhЁС3.6ЁС103 kJ=1.8ЁС1018 kJЁЃЯрЕБгкШМУКгУСПЃК![]() = 6.2ЁС1013 kg=6.2ЁС1010tЁЃ
= 6.2ЁС1013 kg=6.2ЁС1010tЁЃ

ЁОЬтФПЁПFeЪЧШеГЃЩњЛюжазюГЃгУЕФН№ЪєжЎвЛЁЃЛиД№ЯТСаЮЪЬтЃК
(1)ЩюТёдкГБЪЊЭСШРжаЕФЬњЙмЕРЃЌдкСђЫсбЮЛЙдОњ(ИУЛЙдОњзюМбЩњДцЛЗОГдкpHЮЊ7ЁЋ8жЎМф)зїгУЯТЃЌФмБЛSO42-ИЏЪДЃЌЦфЕчЛЏбЇИЏЪДдРэШчЯТЭМЫљЪОЃЌаДГіе§МЋЕФЕчМЋЗДгІЪН___________________ЁЃ
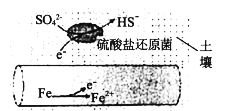
(2)дк1800KЪБЃЌ2Fe(s)+3/2O2(g)=Fe2O3(s) H=-354.2kJ/molЃЛ3Fe(s)+2O2(g)=Fe3O4(s) H=-550.9kJ/molдђЗДгІЃК2Fe3O4(s)+1/2O2(g) ===3Fe2O3(s)ЕФHЮЊ_____ kJЁЄmol1ЃЌЫФбѕЛЏШ§ЬњдкГфТњбѕЦјЕФМЏЦјЦПжаЗДгІЩњГЩFe2O3_____(ЬюЁАФмЁБЛђЁАВЛФмЁБ)здЗЂНјааЁЃ
(3)Fe3+КЭIЃдкЫЎШмвКжаЕФЗДгІШчЯТЃК2IЃ+2Fe3+![]() 2Fe2+ +I2(дкЫЎШмвКжа)ЁЃ
2Fe2+ +I2(дкЫЎШмвКжа)ЁЃ
Ђй298KЪБЃЌЯђ5mL 0.1molL1 ЕФKIШмвКжаЕЮМг0.1molL1 FeCl3ШмвКЃЌЕУЕНc(Fe2+)гыМгШыFeCl3 ШмвКЬхЛ§ЙиЯЕШчЯТЭМЫљЪОЃК
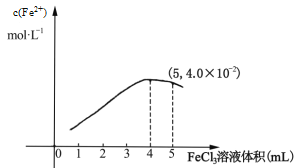
ИУЮТЖШЯТЕЮМг5mL FeCl3ШмвКЪБЃЌFe3+ЕФЦНКтзЊЛЏТЪ=_____%ЃЌЦНКтГЃЪ§K=_____ЃЌШєвЊЬсИпFe3+ЕФзЊЛЏТЪЃЌПЩВЩШЁЕФДыЪЉЪЧ________________________ЁЃ
ЂкдквбОДяЕНЦНКтЕФЩЯЪіЗДгІЬхЯЕжаЃЌМгШыБНЖдI2НјаанЭШЁЃЌБЃГжЮТЖШВЛБфЃЌЗДгІЫйТЪ_____ (ЬюЁАдіДѓЁБЁЂЁАМѕаЁЁБЛђЁАВЛБфЁБ)ЃЌДЫЪБІд(е§)_____Ід(Фц)(ЬюЁАДѓгкЁБЁЂЁАаЁгкЁБЛђЁАЕШгкЁБ)ЁЃ
ЂлІд(е§)гыFe3+ЁЂIЕФХЈЖШЙиЯЕЮЊІд=kc(IЃ)mc(Fe3+)n(kЮЊГЃЪ§)
c(I)molL1 | c(Fe3+)molL1 | Ід (molL1s1 ) | |
(1) | 0.20 | 0.80 | 0.032k |
(2) | 0.60 | 0.40 | 0.144k |
(3) | 0.80 | 0.20 | 0.128k |
ЭЈЙ§ЗжЮіЫљИјЪ§ОнМЦЫуПЩжЊЃКдкІд=kc(IЃ)mc(Fe3+)n жаЃЌmЃЌnЕФжЕЮЊ_____(ЬюзжФИДњКХ)ЁЃ
AЃЎm=1ЃЌn=1ЁЁ BЃЎm=2ЃЌn=1 ЁЁCЃЎm=2ЃЌn=2 ЁЁDЃЎm=1ЃЌn=2




