题目内容
1.有一包白色固体,可能含有K2CO3、NaNO3、KCl、BaSO4、CuSO4.按下列步骤实验:①取少量固体溶于水,得到无色溶液;②在所得的溶液中滴加硝酸银溶液,得到白色沉淀,再加稀硝酸,白色沉淀部分溶解,并有气体产生.根据上述实验现象判断:(1)一定存在的物质是K2CO3、KCl;
(2)一定不存在的物质是BaSO4、CuSO4;
(3)可能存在的物质是NaNO3.
分析 ①溶于水得到无色溶液,说明无CuSO4;无沉淀,说明不含有BaSO4;
②向溶液中加入AgNO3溶液,得到白色沉淀,加硝酸沉淀部分溶解且有气体生成,说明一定含有氯离子,即含有KCl,有气泡放出,说明一点含有K2CO3,据此不能判断NaNO3的存在.
解答 解:①溶于水得到无色溶液,说明无CuSO4;无沉淀,说明不含有BaSO4;
②向溶液中加入AgNO3溶液,得到白色沉淀,加硝酸沉淀部分溶解且有气体生成,说明一定含有氯离子,即含有KCl,有气泡放出,说明一点含有K2CO3,据此不能判断NaNO3的存在,依据此分析可知:
(1)一定存在:K2CO3、KCl,故答案为:K2CO3、KCl;
(2)一定不存在:BaSO4、CuSO4,故答案为:BaSO4、CuSO4;
(3)可能存在:NaNO3,故答案为:NaNO3.
点评 本题考查了物质的性质和反应现象的应用,主要是考查物质相互共存的判断,注意常见的有色溶液以及难溶物是解决本题的关键.

练习册系列答案
相关题目
11.下列物质中含原子数最多的是( )
| A. | 6.4g O2 | B. | 8.8g CO2 | C. | 0.1mol N2 | D. | 3.01×1022个H2O |
12.镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
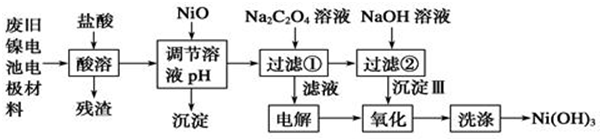
已知:①NiCl2易溶水,Fe3+不能氧化Ni2+
②该温度下一些难溶物的Ksp及沉淀析出的理论pH如表所示:
回答下列问题:
(1)该工艺流程中多次重复利用的一种实验基本操作是过滤.
(2)酸溶所留残渣的主要成分为炭粉(填物质名称)
(3)根据上表数据判断,用NiO调节溶液的pH,依次析出是沉淀Fe(OH)3和沉淀Al(OH)3(填化学式),
控制两种沉淀析出可利用C.
A.pH试纸 B.石蕊指示剂 C.pH计
(4)已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则加入Na2C2O4溶液发生的化学反应方程式是NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(5)氧化步骤的离子反应方程式2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(6)FeCl3和AlCl3的混合溶液中加入NaOH溶液,若Fe(OH)3和Al(OH)3同时存在,则$\frac{c(F{e}^{3+})}{c(A{l}^{3+})}$=2.0×10-5.

已知:①NiCl2易溶水,Fe3+不能氧化Ni2+
②该温度下一些难溶物的Ksp及沉淀析出的理论pH如表所示:
| Ksp | 开始沉淀pH | 沉淀完全pH | |
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
| NiC2O4 | 4.0×10-10 | -- | -- |
(1)该工艺流程中多次重复利用的一种实验基本操作是过滤.
(2)酸溶所留残渣的主要成分为炭粉(填物质名称)
(3)根据上表数据判断,用NiO调节溶液的pH,依次析出是沉淀Fe(OH)3和沉淀Al(OH)3(填化学式),
控制两种沉淀析出可利用C.
A.pH试纸 B.石蕊指示剂 C.pH计
(4)已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则加入Na2C2O4溶液发生的化学反应方程式是NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(5)氧化步骤的离子反应方程式2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(6)FeCl3和AlCl3的混合溶液中加入NaOH溶液,若Fe(OH)3和Al(OH)3同时存在,则$\frac{c(F{e}^{3+})}{c(A{l}^{3+})}$=2.0×10-5.
9.氢能是未来能源结构中最具发展潜力的清洁能源之一.目前已有专家已研究出用淀粉或纤维素与水在酶作用下转变为二氧化碳和氢气的方法制氢气.下列说法错误的是( )
| A. | 从整个循环来看,利用该方法得到的氢能来源于太阳能 | |
| B. | 上述制氢气的化学方程式可表示为:(C6H10O5)n+7nH2O$\stackrel{酶}{→}$ 6nCO2↑+12nH2↑ | |
| C. | 氢元素的三种同素异形体${\;}_{1}^{1}H$、${\;}_{1}^{2}H$、${\;}_{1}^{3}H$,能形成六种单质 | |
| D. | 从化学的本质看该反应属于氧化还原反应 |
6.某油脂样品跟氢氧化钠溶液共热后经酸化得到3种有机物,原样品最多可能含有的三羧酸甘油酯有( )
| A. | 3种 | B. | 6种 | C. | 7种 | D. | 8种 |
6.下列说法中正确的是( )
| A. | 分子中共价键键能越高,键长越长,则分子越稳定 | |
| B. | 元素周期表中的ⅡA族和ⅦA族元素的原子间不能形成共价键 | |
| C. | 水分子可表示为H-O-H,分子中键角为180° | |
| D. | N-N、N=N、N≡N键能之比为1.00:2.17:4.90,说明N2分子中π键键能>σ键键能 |
