题目内容
6.下列说法中正确的是( )| A. | 分子中共价键键能越高,键长越长,则分子越稳定 | |
| B. | 元素周期表中的ⅡA族和ⅦA族元素的原子间不能形成共价键 | |
| C. | 水分子可表示为H-O-H,分子中键角为180° | |
| D. | N-N、N=N、N≡N键能之比为1.00:2.17:4.90,说明N2分子中π键键能>σ键键能 |
分析 A.分子中共价键键能越高,键长越短;
B.形成共价键的两种元素的电负性之差小于1.7时,可形成共价键;
C.水分子为V形;
D.N=N、N≡N中都含有1个δ键,分别含有1、2个π键.
解答 解:A.分子中共价键键能越高,键长越短,键能越小,分子越不稳定,故A错误;
B.形成共价键的两种元素的电负性之差小于1.7时,可形成共价键,如Be和I形成的化合物可能为共价化合物,故B错误;
C.水分子含有2个δ键和2对孤对电子,为V形,故C错误;
D.N=N、N≡N中都含有1个δ键,分别含有1、2个π键,由N-N、N=N、N≡N键能之比为1.00:2.17:4.90,说明N2分子中π键键能>σ键键能,故D正确.
故选D.
点评 本题考查了键能、键长与分子稳定性的关系、共价键的形成、键能与能量的关系等知识点,为高频考点,侧重于基本概念的综合理解和运用的考查,难度不大,注意金属和非金属化合可能形成离子键,也可能形成共价键.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
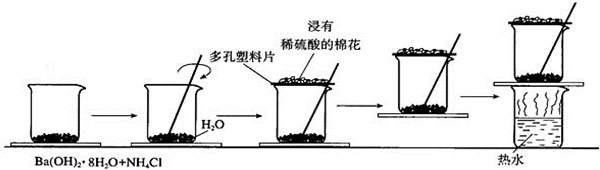
2.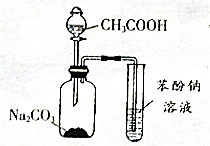 下列关于如图实验的说法错误的是( )
下列关于如图实验的说法错误的是( )
 下列关于如图实验的说法错误的是( )
下列关于如图实验的说法错误的是( )| A. | 集气瓶中的离子方程式是:2CH3COOH+CO32-→2CH3COO-+H2O+CO2 ↑ | |
| B. | 少量的CO2通入苯酚钠中生成苯酚和碳酸钠 | |
| C. | 醋酸和苯酚钠发生反应 | |
| D. | 该装置和相关实验现象能推出酸性强弱顺序为:CH3COOH>H2CO3 >C6H5OH |
19.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
回答下列问题:
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为:2MnO2+Zn+2H+=2MnOOH+Zn2+.
(2)维持电流强度为0.5A,电池工作五分钟,理论消耗锌0.05g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,两者可以通过加热浓缩冷却结晶分离回收,滤渣的主要成分是MnO2、碳粉和MnOOH,欲从中得到较纯的MnO2,最简便的方法是空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰.
(4)用废电池的锌皮制作ZnSO4•7H2O的过程中,需除去铁皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2,溶解,铁变为Fe3+加碱调节pH为2.7时,铁刚好沉淀完全(离子浓度小于1×10-5mol•L-1时,即可认为该离子沉淀完全).继续加碱调节pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol•L-1).若上述过程不加H2O2的后果是Zn2+和Fe2+分离不开,原因是Zn(OH)2、Fe(OH)2的Ksp相近.
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为:2MnO2+Zn+2H+=2MnOOH+Zn2+.
(2)维持电流强度为0.5A,电池工作五分钟,理论消耗锌0.05g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,两者可以通过加热浓缩冷却结晶分离回收,滤渣的主要成分是MnO2、碳粉和MnOOH,欲从中得到较纯的MnO2,最简便的方法是空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰.
(4)用废电池的锌皮制作ZnSO4•7H2O的过程中,需除去铁皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2,溶解,铁变为Fe3+加碱调节pH为2.7时,铁刚好沉淀完全(离子浓度小于1×10-5mol•L-1时,即可认为该离子沉淀完全).继续加碱调节pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol•L-1).若上述过程不加H2O2的后果是Zn2+和Fe2+分离不开,原因是Zn(OH)2、Fe(OH)2的Ksp相近.
1.下列说法中正确的是(NA表示阿伏加德罗常数)( )
| A. | 60gSiO2晶体中含有2NA个Si-O键 | |
| B. | 18D2O(重水)完全电解,转移2NA个电子 | |
| C. | 1Llmol•L-1 Na2CO3溶液中CO32-数为NA | |
| D. | 16g甲烷含有σ数目为4NA |
11.下列叙述正确的是( )
| A. | 糖类、油脂、蛋白质和DNA都是提供人体能量的重要物质基础 | |
| B. | 塑料管材、奶瓶、食物保鲜膜、大棚塑料薄膜等主要材料是聚氯乙烯 | |
| C. | SO2、NO2、NO、氟氯烃、CO2等均是造成大气污染的重要物质 | |
| D. | 氢键、分子间作用力、离子键和共价键均为微粒间的相互作用力 |
18.有关化学用语正确的是( )
| A. | 乙烯的结构简式CH2CH2 | B. | 乙醇的结构简式C2H6O | ||
| C. | 四氯化碳的结构式CCl4 | D. | 乙炔的分子式C2H2 |
15.下列说法正确的是( )
| A. | 有些活泼金属,如铝可作还原剂法的还原剂 | |
| B. | 用电解NaCl溶液的方法来冶炼金属钠 | |
| C. | 可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |