题目内容
【题目】常温下,量取![]() 的两种二元酸
的两种二元酸![]() 与
与![]() 各
各![]() ,分别加水稀释,测得pH与加水稀释倍数有如图所示关系,则下列有关叙述不正确的是
,分别加水稀释,测得pH与加水稀释倍数有如图所示关系,则下列有关叙述不正确的是

A.![]() 为弱酸
为弱酸
B.NaHA水溶液中:![]()
C.含等物质的量的NaHA、NaHB的混合溶液中:![]()
D.![]() 的NaHB溶液中:
的NaHB溶液中:![]()
【答案】D
【解析】
A.![]() 溶液稀释200倍,溶液pH增加2个单位,说明
溶液稀释200倍,溶液pH增加2个单位,说明![]() 为弱酸,故A正确;
为弱酸,故A正确;
B.根据图象知,![]() 溶液稀释100倍,溶液pH由2增至4,说明
溶液稀释100倍,溶液pH由2增至4,说明![]() 是强酸。NaHA水溶液中存在
是强酸。NaHA水溶液中存在![]() 、
、![]() ,根据电荷守恒可知
,根据电荷守恒可知![]() ,故B正确;
,故B正确;
C.根据图象知,![]() 溶液稀释100倍,溶液pH由2增至4,说明
溶液稀释100倍,溶液pH由2增至4,说明![]() 是强酸。
是强酸。![]() 溶液稀释200倍,溶液pH增加2个单位,说明
溶液稀释200倍,溶液pH增加2个单位,说明![]() 为弱酸,含等物质的量的NaHA、NaHB的混合溶液中,根据物料守恒可得:
为弱酸,含等物质的量的NaHA、NaHB的混合溶液中,根据物料守恒可得:![]() ,故C正确;
,故C正确;
D.![]() 溶液稀释200倍,溶液pH增加2个单位,说明
溶液稀释200倍,溶液pH增加2个单位,说明![]() 为弱酸,
为弱酸,![]() 的NaHB溶液,
的NaHB溶液,![]() 水解程度大于其电离程度,钠离子不水解,导致溶液呈碱性,则溶液中离子浓度大小顺序是
水解程度大于其电离程度,钠离子不水解,导致溶液呈碱性,则溶液中离子浓度大小顺序是![]() ,故D错误。
,故D错误。
故选D。

 黄冈冠军课课练系列答案
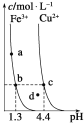
黄冈冠军课课练系列答案【题目】氯化铜晶体(CuCl22H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。

请参照下表给出的数据填空。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Cu2+ Fe2+ Fe3+ | 4.7 7.0 1.9 | 6.7 9.0 3.2 |
(1)操作I加入X的目的是_________________________。
(2)下列物质都可以作为X,最适合本实验的X物质可以是(填选项)_________。
A.KMnO4 B.H2O2 C.NaClO D.Cl2
(3)操作II的Y试剂为(填化学式)_________,并调节溶液的pH在_________范围。
(4)操作III的程序依次为蒸发浓缩、冷却结晶、过滤、自然干燥、得到CuCl22H2O晶体。
(5)实验室在配制CuCl2溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示):________________。