题目内容
【题目】下列叙述正确的是
A.常温下,将稀氨水逐滴加入稀硫酸中,当溶液的![]() 时,
时,![]()
B.两种醋酸溶液的物质的量浓度分别为![]() 和
和![]() ,pH分别为a和
,pH分别为a和![]() ,则
,则![]()
C.常温下,![]() 的NaOH溶液与
的NaOH溶液与![]() 的醋酸溶液等体积混合,滴入石蕊溶液呈红色
的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向![]() 的氨水中加入少量硫酸铵固体,则溶液中
的氨水中加入少量硫酸铵固体,则溶液中![]() 的值增大
的值增大
【答案】C
【解析】
A.将稀氨水逐滴加入稀硫酸中,当溶液![]() 时,溶液中氢离子浓度等于氢氧根离子浓度;溶液呈电中性,所以阴阳离子所带电量相等,所以
时,溶液中氢离子浓度等于氢氧根离子浓度;溶液呈电中性,所以阴阳离子所带电量相等,所以![]() ,故A错误;
,故A错误;
B.醋酸是弱电解质,在水溶液中只有部分电离,所以醋酸的浓度大于氢离子浓度;两种醋酸溶液的物质的量浓度分别为![]() 和
和![]() ,pH分别为a和
,pH分别为a和![]() 的两种醋酸溶液中氢离子浓度之比
的两种醋酸溶液中氢离子浓度之比![]() :1,当两种酸的电离度相同时,则
:1,当两种酸的电离度相同时,则![]() ,实际上,两种酸的浓度不等,且浓度越大,酸的电离度越小,所以两种酸的浓度关系为
,实际上,两种酸的浓度不等,且浓度越大,酸的电离度越小,所以两种酸的浓度关系为![]() ,故B错误;
,故B错误;
C.![]() 的NaOH溶液的
的NaOH溶液的![]() ,
,![]() 醋酸溶液的
醋酸溶液的![]() ,等体积的两种溶液
,等体积的两种溶液![]() ,醋酸有剩余,但
,醋酸有剩余,但![]() 大于
大于![]() 水解程度,则等体积混合后溶液呈酸性,所以向混合液中滴入石蕊试液呈红色,故C正确;
水解程度,则等体积混合后溶液呈酸性,所以向混合液中滴入石蕊试液呈红色,故C正确;
D.氨水的电离方程式为:![]() ,当向氨水中加入硫酸铵时,硫酸铵中含有铵根离子,导致氨水的电离平衡向逆反应方向移动,溶液中氢氧根离子浓度降低,氨水的浓度增大,铵根离子浓度增大,平衡常数Kb不变,则溶液中
,当向氨水中加入硫酸铵时,硫酸铵中含有铵根离子,导致氨水的电离平衡向逆反应方向移动,溶液中氢氧根离子浓度降低,氨水的浓度增大,铵根离子浓度增大,平衡常数Kb不变,则溶液中 减小,故 D错误。
减小,故 D错误。
故选C。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】在如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,其中P为电解质溶液。由此判断M、N、P所代表的物质可能是( )

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 锌 | 稀硫酸 |
C | 银 | 锌 | AgNO3溶液 |
D | 铜 | 铁 |
|
A.AB.BC.CD.D
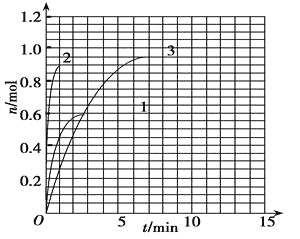
【题目】某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 2.00 | 0.00 |
1 | 0.90 | 1.80 | 0.20 |
3 | 0.75 | 1.50 | 0.50 |
5 | 0.65 | 1.30 | 0.70 |
9 | 0.55 | 1.10 | 0.90 |
10 | 0.55 | 1.10 | 0.90 |
14 | 0.55 | 1.10 | 0.90 |
(1)体系中发生反应的化学方程式____________;
(2)列式计算该反应在0~3 min时间内产物Z的平均反应速率:________;
(3)该反应达到平衡时反应物X的转化率α等于________;
(4)如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1____________,2______________,3______________。