题目内容
20.下列叙述正确的是( )| A. | SO32-中硫原子的杂化方式为sp3 | B. | H2O分子中氧原子的杂化方式为sp2 | ||
| C. | BF3分子呈三角锥体空间型 | D. | C2H2分子中含有3个σ键和2个π键 |
分析 A.根据价层电子对数=成键电子对数+孤电子对数计算;
B.根据价层电子对数=成键电子对数+孤电子对数计算;
C.先判断杂化类型,再判断分子的空间构型;
D.单键中只有一个σ键,三键中有一个σ键和两个π键.
解答 解:A.SO32-中硫原子的价层电子对数=3+$\frac{1}{2}$(6+2-2×3)=4,杂化方式为sp3,故A正确;
B.H2O分子中O原子的价层电子对数=2+$\frac{1}{2}$(6-2×1)=4,杂化方式为sp3,故B错误;
C.BF3分子中B原子的价层电子对数=3+$\frac{1}{2}$(3-3×1)=3,杂化方式为sp2,而且没有孤电子对,所以分子构型为平面三角形,故C错误;
D.C2H2分子的结构式为H-C≡C-H,单键中只有一个σ键,三键中有一个σ键和两个π键,所以C2H2分子中含有3个σ键和2个π键,故D正确.
故选AD.
点评 本题考查了杂化类型的判断、分子的空间构型、共价键的类型,题目难度不大,注意把握价层电子对数的计算方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)写出①~⑨九种元素的元素符号C,N,O,Na,Al,S,Cl,Ar,K
(2)在这些元素中,化学性质最不活泼的是:Ar(填元素符号).
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: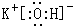 .
.
(4)最高价氧化物是两性氧化物的元素是Al(填元素符号);写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(5)用电子式表示元素④与⑥的化合物的形成过程: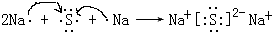 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(6)表示①与③的化合物的电子式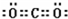 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在这些元素中,化学性质最不活泼的是:Ar(填元素符号).
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
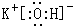 .
.(4)最高价氧化物是两性氧化物的元素是Al(填元素符号);写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(5)用电子式表示元素④与⑥的化合物的形成过程:
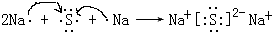 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(6)表示①与③的化合物的电子式
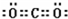 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.
8.下列解释事实的方程式正确的是( )
| A. | 利用铝热反应焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 | |
| B. | 用氯水除去FeCl3溶液中的Fe2+:Cl2+Fe2+═2Cl-+Fe3+ | |
| C. | 用已知浓度的NaOH溶液测定未知浓度的醋酸溶液的浓度:H++OH-═H2O | |
| D. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2Na++2OH-═Na2SiO3+H2O |
15.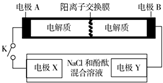 某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
 某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )| A. | K+从右到左通过离子交换膜 | |
| B. | A的电极反应式为:3I--2e-=I3- | |
| C. | 当有0.1 mol K+通过离子交换膜,X电极上产生气体1.12 L(标准状况下) | |
| D. | 电池充电时,B电极要与外电源的正极相连,电极上发生还原反应 |
5.卤代烃在生产生活中具有广泛的应用,下列说法正确的是( )
| A. | 多氯代甲烷中分子结构为正四面体的是二氯甲烷和四氯化碳 | |
| B. | 多氯代烷常为有机溶剂,工业上分离这些多氯代物的方法是萃取 | |
| C. | 三氟氯溴乙烯(CF3CHClBr)是一种麻醉剂,有4种同分异构体(不考虑立体异构) | |
| D. | 聚氯乙烯是生活中常用的塑料,工业上以乙烯为原料经过加成、消去和聚合反应可生成聚氯乙烯 |
9.下列关于25℃的NaHCO3溶液的相关事实,能够证明H2CO3为弱酸的是( )
| A. | 溶液中存在CO32- | B. | 溶液中c(Na+)>c(CO32-) | ||
| C. | 与等物质的量的NaOH恰好中和 | D. | 溶液中c(H+)•c(OH-)=10-14 |
10.化学与生活密切相关,下列说法正确的是( )
| A. | 使用漂白液时不可与酸性洁厕剂混用 | |
| B. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 | |
| C. | 葡萄糖、油脂、蛋白质等进入人体内经水解后被吸收 | |
| D. | 铝壶表面有致密氧化膜耐腐蚀,可长期存放食醋 |
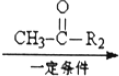 R1-CH=
R1-CH=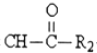 +H2O
+H2O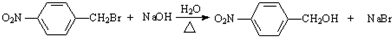 .
. .
.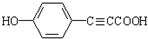 .
.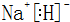 .
.