题目内容
5.(1)对工业合成氨条件的探索一直是化学工业的重要课题,在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应,如图1(图中所示数据均为初始物理量).t分钟后反应均达到平衡,生成NH3均为0.4mol(忽略水对压强的影响及氨气的溶解).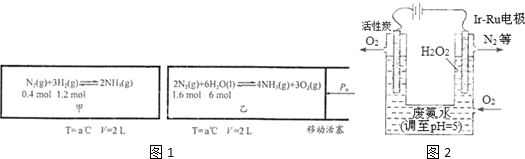
①判断甲容器中的反应达平衡的依据是ACE.(填写相应编号)
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(N2)不随时间改变
D.单位时间内生成2molNH3的同时消耗1molN2
E.单位时间内断裂3mol H-H键,同时断裂6mol N-H键
②该条件下甲容器中反应的平衡常数K=$\frac{400}{27}$;平衡时,甲的压强p平=$\frac{3}{4}$P0(初始压强用p0表示).
③该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转化率=12.5%.
(2)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图2
①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)<c(NO3-)(填“>”、“<”或“=”).
②Ir-Ru惰性电极有吸附O2作用,该电极上的反应为O2+2H++2e-═H2O2.
③理论上电路中每转移3mol电子,最多可以处理NH3•H2O的物质的量为1mol.
分析 (1)①根据化学平衡状态的特征来确定化学平衡状态;
②平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,化学平衡常数只与温度有关;根据“三段式”来进行计算得出结论;在恒温恒容的容器中压强之比等于气体的物质的量比;
③根据温度不变化学平衡常数不变结合“三段式”计算得出达到平衡时N2转换率;
(2)①根据溶液呈电中性,溶液中阳离子所带的正电荷总数等于溶液中阴离子所带的负电荷总数进行解答;
②在该电解池中,Ir-Ru惰性电极有吸附O2作用为氧气得电子发生还原反应,在酸性条件下生成过氧化氢;
③根据4NH3+3O2?2N2+6H2O,每转移12mol电子,处理4mol氨气,据此分析解答.
解答 解:(1)解:①A.反应前后气体的系数和不相等,当压强不随时间改变的状态是平衡状态,故A正确;
B.气体的密度等于混合气体质量和体系体积的比值,体系质量和体积均不变,所以密度不变的状态不一定是平衡状态,故B错误;
C.c(N2)不随时间改变,是化学平衡状态的特征,故C正确;
D.单位时间内生成2molNH3的同时消耗1molN2,不能证明正逆反应速率是相等的,故D错误;
E.单位时间内断裂3molH-H键,同时断裂6molN-H键,能证明正逆反应速率是相等的,故E正确;
故答案为:ACE;
②根据题意:甲容器
$\frac{0.{2}^{2}}{0.1×0.{3}^{3}}$N2(g)+3H2(g)?2NH3(g),
初始物质的量:0.4mol 1.2mol 0
变化物质的量:0.2mol 0.6mol 0.4mol
平衡物质的量:0.2mol 0.6mol 0.4mol
体积为2L,则C(N2)=0.1mol/L,C(H2)=0.3mol/L,C(NH3)=0.2mol/L,平衡常数为K=$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]•[{H}_{2}]^{3}}$=$\frac{0.{2}^{2}}{0.1×0.{3}^{3}}$=$\frac{400}{27}$,初始气体总物质的量=0.4mol+1.2mol=1.6mol,平衡时气体总物质的量:0.2mol+0.6mol+0.4mol=1.2mol,在恒温恒容的容器中压强之比等于气体的物质的量比;甲的压强P平=$\frac{1.2}{1.6}$P0=$\frac{3}{4}$P0,
故答案为:$\frac{400}{27}$;$\frac{3}{4}$P0;
③化学平衡常数只与温度有关,乙为恒温恒压,根据题意:乙容器2N2(g)+6H2O(l)?4NH3(g)+3O2(g),
初始物质的量:1.6mol 6mol 0 0
变化物质的量:0.2mol 0.6mol 0.4mol 0.3mol
平衡物质的量:1.4mol 5.4mol 0.4mol 0.3mol
体积为2L,则C(N2)=0.7mol/L,C(H2O)=2.7mol/L,C(NH3)=0.2mol/L,C(O2)=0.15mol/L,平衡常数为K=$\frac{[{O}_{2}]^{3}•[N{H}_{3}]^{4}}{[{N}_{2}]^{2}•[{H}_{2}O]^{6}}$=$\frac{0.{3}^{3}×0.{4}^{4}}{1.{4}^{2}×5.{4}^{6}}$,若向乙中继续加入0.2mol N2,再充入氮气是等容等效过程,转化率就是原来的转化率则X=$\frac{0.2}{1.6}$×100%=12.5%,
故答案为:12.5%;
(2)①向废氨水加入适量硝酸调节溶液的pH约为5,根据溶液呈电中性,溶液中c(NH4+)+c(H+)=c(NO3-)+c(OH-),pH约为5呈酸性,c(H+)>c(OH-),所以
c(NH4+)<c(NO3-),
故答案为:<;
②利用电解法制H2O2,在该电解池中,Ir-Ru惰性电极有吸附O2作用为氧气得电子发生还原反应,O2+2H++2e-═H2O2,
故答案为:O2+2H++2e-═H2O2;
③4NH3+3O2?2N2+6H2O中,氨气中的氮元素从-3价变为氮气中的0价,4mol氨气转移12mol电子,所以转移3mol电子,最多可以处理NH3•H2O的物质的量为1mol,
故答案为:1mol.
点评 本题考查较综合,涉及化学平衡及化学平衡的计算、电极反应式的书写等,掌握平衡常数的应用、根据溶液的电中性判断离子浓度大小是解答该题的关键,题目难度中等.

 它违背了( )
它违背了( )| A. | 能量守恒原理 | B. | 能量最低原理 | C. | 泡利不相容原理 | D. | 洪特规则 |
| A. | 1molD(氘)的质量与NA个T(氚)的质量相等 | |
| B. | NA个氧分子和NA个氢分子的质量比为16:1 | |
| C. | 28g氮气所含原子数目为2NA | |
| D. | 在标准状况下,0.5NA个氯气分子所占的体积约是11.2L |
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
| 混合物 | 需加入的试剂 | 分离方法 |
| 苯(苯酚) | ||
| 乙烷(乙烯) | c | C |
| 乙醇(水) | e | |
| 乙酸乙酯(乙酸) |
| A. | 用电子式表示氯化氢分子的形成过程: | |
| B. | 一定条件下从正反应开始的某可逆反应达到化学平衡时,正反应速率降到最小 | |
| C. | 酸与碱发生中和反应时放出的热量叫中和热 | |
| D. | 催化剂不但能改变反应速率,也能改变反应进行的限度 |
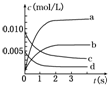 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)=2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)=2SO3(g)体系中,n(SO2)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图所示,表示SO3变化曲线的是b,用O2表示从0s~2s内该反应的平均速率:v=0.0015mol/(L•s);
(3)能说明该反应已达到平衡状态的是bc.
a.v(SO3)=2v(O2)
b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2)
d.容器内密度保持不变
(4)若上述条件下该反应的△H=-190kJ•mo1-1,若要得到380kJ热量,则加入各物质的物质的量可能是BD.
A.4mo1SO2和2mol O2
B.6mol SO2和6mo1O2
C.4mol SO2和4mo1O2
D.6mo1SO2和4mo1O2.
| A. | 还原性:X的氢化物>Y的氢化物>Z的氢化物 | |
| B. | 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 | |
| C. | YX2与M2Y的水溶液在酸性条件下不能反应 | |
| D. | Z元素最高价氧化物对应的水化物的化学式为HZO4 |
| A. | 醋酸可用作调味剂及防腐剂 | B. | CO2和CH4都是温室气体 | ||
| C. | 阿司匹林可用作抗酸药 | D. | 植物油可用于制备人造黄油 |