题目内容
13.氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃,氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g)$\stackrel{活性炭}{?}$SO2Cl2;△H=-97.3kJ/mol(1)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是AC(用编号填空).
A.减小容器体积B.使用催化剂C.增加SO2浓度D.升高温度
(2)已知20℃时,AgCl的溶解度为0.00015g,Ag2SO4的溶解度为0.796g.则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是AgCl.
(3)已知:氯化硫酰遇水生成中学化学常见的两种强酸,请写出其化学方程式SO2Cl2+2H2O═H2SO4+2HCl.
(4)将33.75gSO2Cl2溶于足量的BaCl2溶液中,当沉淀达到最大值时过滤,将所得虑液稀释为1L,计算其pH(写出计算过程).0.
分析 (1)提高反应中Cl2的平衡转化率,改变条件使平衡向正反应移动,根据平衡移动原理结合选项分析解答,注意不能增大氯气的用量;
(2)氯化银的溶解度远远小于Ag2SO4的溶解度,SO2Cl2溶于水所得溶液中c(H2SO4):c(HCl)=1:2,溶液中离子浓度为硫酸根离子的2倍,故AgCl最先沉淀;
(3)SO2Cl2遇水生成硫酸和氯化氢,根据原子守恒书写;
(4)发生反应SO2Cl2+2H2O═H2SO4+2HCl,H2SO4+BaCl2═BaSO4↓+2HCl,根据n=$\frac{m}{M}$计算SO2Cl2的物质的量,由SO2Cl2的物质的量计算最终溶液中氢离子的浓度,据此计算pH.
解答 解:(1)提高反应中Cl2的平衡转化率,改变条件使平衡向正反应移动,不能增大氯气的用量,
A.缩小容器体积,压强增大,平衡向正反应移动,Cl2的转化率增大,故A正确;
B.使用催化剂,缩短到达平衡的时间,不影响平衡移动,Cl2的转化率不变,故B错误;
C.增加SO2浓度,平衡向正反应移动,Cl2的转化率增大,故C正确;
D.该反应正反应是放热反应,升高温度,平衡向逆反应移动,Cl2的转化率降低,故D错误;
故答案为:AC;
(2)氯化银的溶解度远远小于Ag2SO4的溶解度,SO2Cl2溶于水所得溶液中c(H2SO4):c(HCl)=1:2,溶液中离子浓度为硫酸根离子的2倍,故AgCl最先沉淀,
故答案为:AgCl;
(3)SO2Cl2遇水生成硫酸和氯化氢,则其水解方程式为:SO2Cl2+2H2O═H2SO4+2HCl,故答案为:SO2Cl2+2H2O═H2SO4+2HCl;
(4)发生反应SO2Cl2+2H2O═H2SO4+2HCl,SO2Cl2的物质的量为$\frac{33.75g}{135g/mol}$=0.25mol,由SO2Cl2+2H2O═H2SO4+2HCl可得生成n(H2SO4)=0.25mol,生成n(HCl)=0.5mol,又H2SO4+BaCl2═BaSO4↓+2HCl,所以硫酸又转化成HCl,又生成n(HCl)=0.5mol,故所得虑液中含HCl为1mol,氢离子浓度为$\frac{1moL}{1L}$=1mol/L,则pH=0,故答案为:0.
点评 本题考查化学平衡的影响因素、沉淀转化、化学计算等,难度中等,(4)中计算注意根据方程式进行计算.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案| A. | 漂白粉溶液在空气中长时间放置:ClO-+CO2+H2O=HClO+HCO3- | |
| B. | FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | AgNO3溶液中加入过量稀氨水:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| D. | SO2使氯水褪色:SO2+Cl2+2H2O=SO42-+2Cl-+4H+ |
| A. | 聚乙烯的结构简式: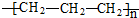 | B. | 丙烷分子的比例模型: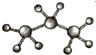 | ||
| C. | 四氯化碳分子的电子式: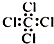 | D. | 2-乙基-1,3-丁二烯分子的键线式: |
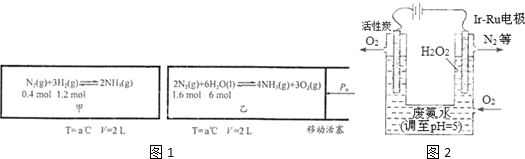
| A. | 3:2:1 | B. | 2:6:3 | C. | 3:6:2 | D. | 2:1:3 |
| A | B |
| C | D |
| A. | 原子半径:C>A=D>B | |
| B. | 最高价氧化物对应的水化物酸性:B>D | |
| C. | 气态氢化物的稳定性:C>D>B | |
| D. | C的气态氢化物的水溶液在空气中放置会出现浑浊现象,可以说明非金属性A>C |
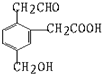 某有机物的结构式为它在一定条件下(如图)能发生的反应有( )
某有机物的结构式为它在一定条件下(如图)能发生的反应有( )①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去.
| A. | ②③④ | B. | ①③⑤⑥ | C. | ①③④⑤ | D. | ②③④⑤ |
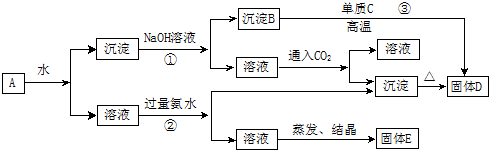
 和
和
 和
和