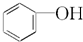
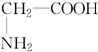题目内容
17.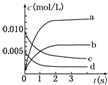 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)=2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)=2SO3(g)体系中,n(SO2)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图所示,表示SO3变化曲线的是b,用O2表示从0s~2s内该反应的平均速率:v=0.0015mol/(L•s);
(3)能说明该反应已达到平衡状态的是bc.
a.v(SO3)=2v(O2)
b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2)
d.容器内密度保持不变
(4)若上述条件下该反应的△H=-190kJ•mo1-1,若要得到380kJ热量,则加入各物质的物质的量可能是BD.
A.4mo1SO2和2mol O2
B.6mol SO2和6mo1O2
C.4mol SO2和4mo1O2
D.6mo1SO2和4mo1O2.
分析 (1)从图象分析,随反应时间的延长,各物质的浓度不再不变,且反应物没有完全反应,二氧化硫在5s时浓度不变说明达到平衡状态,转化率=$\frac{消耗量}{起始量}$×100%;
(2)根据二氧化硫物质的量的变化知,该反应向正反应方向移动,则三氧化硫的物质的量在不断增大,且同一时间段内,二氧化硫减少的物质的量等于三氧化硫增加的物质的量;根据△v=$\frac{\frac{△n}{V}}{△t}$计算二氧化硫的反应速率,再结合同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比计算氧气的反应速率;
(3)反应达到平衡的标志是正逆反应速率相同,各成分含量保持不变,反应过程中“变量不变”是分析的依据;
(4)2molSO2完全反应放出190kJ的热量,则要得到380kJ热量,则4molSO2完全反应,注意可逆反应的特点分析.
解答 解:(1)从图象分析,随反应时间的延长,各物质的浓度不再不变,且反应物没有完全反应,所以反应为可逆反应,二氧化硫在5s时浓度不变说明达到平衡状态,转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.02mol-0.007mol}{0.02mol}$×100%=65%,
故答案为:是;65%;
(2)根据二氧化硫物质的量的变化知,该反应向正反应方向移动,则三氧化硫的物质的量在不断增大,且同一时间段内,二氧化硫减少的物质的量等于三氧化硫增加的物质的量,所以表示SO3的变化的曲线是b,
0~2s内v(SO2)=$\frac{\frac{0.02mol-0,008mol}{2L}}{2s}$=0.0030mol/(L.min),同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以氧气的反应速率V(O2)=$\frac{1}{2}$v(SO2)=0.0015mol/(L•s),
故答案为:b;0.0015mol/(L•s);
(3)a.v(SO3)=2v(O2),只是表示了正反应速率之比,无法判断正逆反应速率是否相等,故a错误;
b.反应前后气体体积不同,压强不变说明正逆反应速率相等,各组分浓度不变,故b正确;
c.v逆(NO)=2v正(O2)时,说明一氧化氮正逆反应速率相等,反应达到平衡状态,故c正确;
d.恒容容器,反应物生成物都是气体质量不变,所以密度不变不一定平衡,故d错误;
故选:bc;
(4)2molSO2完全反应放出190kJ的热量,则要得到380kJ热量,则4molSO2完全反应,因反应为可逆反应,不能完全转化,则同时满足n(SO2)>4,n(O2)>2即可,显然只有BD符合,
故答案为:BD.
点评 本题考查较综合,涉及化学反应速率计算、化学平衡状态判定、反应速率影响因素、化学平衡计算及能量转化,综合性较强,题目难度中等,注重高考高频考点的考查,侧重分析能力、计算能力的夯实.

| A. | M与X形成的化合物对应的水化物一定是强酸 | |
| B. | Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 | |
| C. | X、Y的简单离子半径:r(X2-)>r(Y+) | |
| D. | X的气态氢化物比M的气态氢化物稳定 |
| A | B |
| C | D |
| A. | 原子半径:C>A=D>B | |
| B. | 最高价氧化物对应的水化物酸性:B>D | |
| C. | 气态氢化物的稳定性:C>D>B | |
| D. | C的气态氢化物的水溶液在空气中放置会出现浑浊现象,可以说明非金属性A>C |
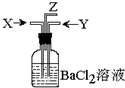 碳跟浓硫酸共热产生的气体X和二氧化锰跟浓盐酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是…( )
碳跟浓硫酸共热产生的气体X和二氧化锰跟浓盐酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是…( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | |
| B. | 在Z导管出来的气体中无二氧化碳 | |
| C. | 洗气瓶中产生的沉淀是硫酸钡 | |
| D. | 洗气瓶中产生的沉淀是碳酸钡和亚硫酸钡 |
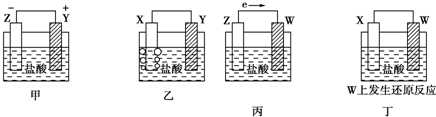
| A. | Z>Y>X>W | B. | Z>X>Y>W | C. | Z>Y>W>X | D. | Y>Z>X>W |
| A. | 强氧化性和脱水性 | B. | 强氧化性和吸水性 | ||
| C. | 难挥发性和酸性 | D. | 脱水性和吸水性 |
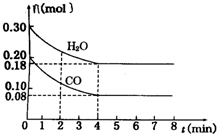 在一体积为2L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)
在一体积为2L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)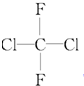 和
和
 和
和