题目内容
19.下列相关实验不能达到预期目的是( )| 相关实验 | 预期目的 | |
| ① | 在两份同浓度同体积的H2O2溶液中,分别加2滴FeCl3溶液和2滴CuCl2溶液,前者放在热水中,后者放在冰水中.观察气泡快慢; | 验证温度对化学反应速率的影响. |
| ② | 将氯水加入淀粉KI溶液中 | 验证Cl的非金属性比I强 |
| ③ | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率. | 比较同周期金属元素的金属性强弱. |
| ④ | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
| A. | 仅① | B. | ①④ | C. | ②③ | D. | ③④ |
分析 ①催化剂不同,温度不同;
②氯水氧化KI生成碘单质,淀粉遇碘变蓝;
③温度、表面积相同,盐酸浓度相同,只有金属不同;
④AlCl3在溶液中电离,但AlCl3为共价化合物.
解答 解:①催化剂不同,温度不同,两个变量不能验证温度对化学反应速率的影响,故错误;
②氯水氧化KI生成碘单质,淀粉遇碘变蓝,则Cl的得电子能力强,可验证Cl的非金属性比I强,故正确;
③温度、表面积相同,盐酸浓度相同,只有金属不同,Mg反应剧烈,则比较同周期金属元素的金属性强弱,故正确;
④AlCl3在溶液中电离,AlCl3溶液导电,但AlCl3为共价化合物,故错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及影响反应速率的因素、氧化性及非金属比较、电离与化合物类别判断等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
9.以下说法正确的是( )
| A. | C60与金刚石一样属于原子晶体 | |
| B. | 干冰升华破坏了共价键 | |
| C. | 共价化合物中一定不含离子键 | |
| D. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 |
10.已知某“瘦肉精”中含有克伦特罗,其结构如图,下列有关克伦特罗的叙述不正确的是( )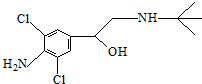

| A. | 该物质在一定条件下可发生消去反应和酯化反应 | |
| B. | 该物质分子中含有6个饱和碳原子 | |
| C. | 1 mol该物质与足量NaOH溶液反应,最多需NaOH 2 mol | |
| D. | 该物质的分子式为C12H18ON2Cl2 |
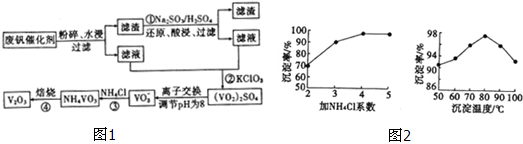
7.为回收利用废钒催化剂(含有V2O5,、及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如图1:
已知部分含钒物质在水中的溶解性如下:
回答下列问靥:
(1)工业由V2O5冶炼金厲钒常用铝热法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(2)滤液中含钒的主要成分为VOSO4 (写化学式).
(3)反应③的沉淀率是回收钒的关键,该步反应的离子方程式为NH4++VO3-=NH4VO3↓;沉淀率的髙
低除受溶液pH影响外,还与氯化按系数(NH4Cl加入质量与样品中V2O5的质量比)和温度有关.根据图2判断最佳氯化铵系数和温度分别为4、80°C.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,该滴定反应的离子方程式2VO2++H2C2O4+2H+═2VOn++2CO2↑+2H2O.若产生2.24L的CO2(标准状况下),则转移电子数为0.1NA.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO${\;}_{2}^{+}$+V2++H+ $?_{放电}^{充电}$ VO2++H2O+V3+
电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.
已知部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)工业由V2O5冶炼金厲钒常用铝热法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(2)滤液中含钒的主要成分为VOSO4 (写化学式).
(3)反应③的沉淀率是回收钒的关键,该步反应的离子方程式为NH4++VO3-=NH4VO3↓;沉淀率的髙
低除受溶液pH影响外,还与氯化按系数(NH4Cl加入质量与样品中V2O5的质量比)和温度有关.根据图2判断最佳氯化铵系数和温度分别为4、80°C.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,该滴定反应的离子方程式2VO2++H2C2O4+2H+═2VOn++2CO2↑+2H2O.若产生2.24L的CO2(标准状况下),则转移电子数为0.1NA.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO${\;}_{2}^{+}$+V2++H+ $?_{放电}^{充电}$ VO2++H2O+V3+
电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.

14.元素周期表与原子结构、元素性质密切相关.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)在这些元素中,在最高价氧化物的水化物中,酸性最强的元素是Cl,碱性最强的元素是K.
(3)表中元素⑥的原子结构示意图是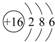 ;④的离子结构示意图
;④的离子结构示意图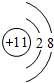 .
.
(4)最高价氧化物的水化物显两性的化合物是Al(OH)3;写出它与④的氢氧化物水溶液反应的离子方程式Al(OH)3+OH-=AlO2-+H2O.
(5)用电子式表示:元素④与⑥形成的化合物: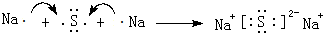 .
.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在这些元素中,在最高价氧化物的水化物中,酸性最强的元素是Cl,碱性最强的元素是K.
(3)表中元素⑥的原子结构示意图是
 ;④的离子结构示意图
;④的离子结构示意图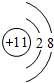 .
.(4)最高价氧化物的水化物显两性的化合物是Al(OH)3;写出它与④的氢氧化物水溶液反应的离子方程式Al(OH)3+OH-=AlO2-+H2O.
(5)用电子式表示:元素④与⑥形成的化合物:
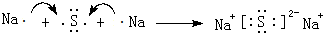 .
.
4.下列叙述从化学角度分析,其中正确的是( )
| A. | 相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃中的碳的质量分数越大 | |
| B. | 相同质量的烃,完全燃烧,消耗的O2越多,说明烃中的氢的质量分数越大 | |
| C. | 银镜反应实验后试管内壁附有银,可用氨水清洗 | |
| D. | 氟利昂(CF2Cl2)或氮氧化物(NOx)气体会破坏大气臭氧层,从而导致“温室效应” |
11.下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是( )
| A. | C3H6、C2H4 | B. | C2H6、C2H6O | C. | C2H4、C2H6O | D. | C3H4、C2H6O |
9.下列由相关实验现象所推出的结论正确的是( )
| A. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 | |
| B. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| C. | Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 | |
| D. | 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |